Aminación de Buchwald-Hartwig
La reacción de Buchwald-Hartwig, también llamada aminación de Buchwald-Hartwig o acoplamiento de Buchwald-Hartwig, es una reacción química usada en química orgánica para la síntesis de enlaces carbono-nitrógeno a través del acoplamiento cruzado de aminas con haluros de arilo, catalizado por paladio. A pesar de algunas publicaciones con un enfoque similar se publicaron ya en 1983, el crédito para su desarrollo se suele asignar a Stephen L. Buchwald y John F. Hartwig, cuyas publicaciones entre 1994 y finales de la década de 2000 establecieron el alcance de la transformación.
La utilidad de esta reacción para las síntesis se deriva principalmente de las deficiencias de los métodos típicos (sustitución nucleófila, aminación reductiva, etc) para la síntesis de enlaces C-N en compuestos aromáticos. El desarrollo de la reacción de Buchwald-Hartwig ha permitido la síntesis fácil de arilaminas, reemplazando a otros métodos (reacción de Goldberg, sustitución nucleófila aromática, etc), mientras que ha aumentado significativamente el repertorio de la posible formación del enlace C-N.
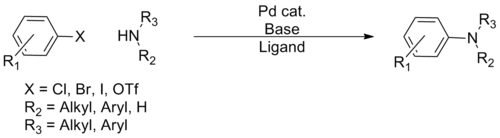
En el transcurso de su desarrollo, se han desarrollado varias 'generaciones' de sistemas catalíticos, con sucesivas mejoras que han permitido un mayor margen en términos de especies químicas a las que acoplarse y de condiciones más suaves, lo que permite prácticamente que cualquier amina pueda acoplarse con una amplia variedad de compuestos de arilo. Debido a la ubicuidad de los enlaces C-N arilo en productos farmacéuticos y productos naturales, la reacción ha conseguido un amplio uso en la química orgánica sintética, la aplicación en muchas síntesis totales y la preparación industrial de numerosos productos farmacéuticos. Se han publicado varias revisiones sobre esta reacción.[1][2][3][4][5][6][7][8][9]
Historia editar
El primer ejemplo de una reacción de acoplamiento cruzado C-N catalizada por paladio fue publicado en 1983 por Migita y colaboradores y se describe una reacción entre varios bromuros de arilo y N,N-dietilamino-tributilestaño utilizando PdCl2[P(o-tolil)3]2> 1% moles . Aunque se pusieron a prueba varios bromuros de arilo, sólo los sustratos electrónicamente neutros, con impedimento estérico, dieron buenos rendimientos.[10]
Luego, en 1984, Dale L. Boger y James S. Panek publicaron un ejemplo de formación de enlaces C-N mediado por Pd (0) en el contexto de su trabajo en la síntesis de lavendamicina que utilizaba Pd(PPh3)4 estequiométrico. Los intentos de conseguir una reacción catalítica no tuvieron éxito.[11]
En febrero de 1994, el grupo de Hartwig publicó un estudio sistemático de los compuestos de paladio que participan en el artículo original de Migita, sus resultados indican que el complejo d10 de Pd[P(o-tolil)3]2 era el catalizador activo (con el correspondiente cloruro entrando en el ciclo catalítico a través de una reducción in situ), y apoyaba la participación de un ciclo catalítico en la adición oxidativa del bromuro de arilo.[12]
En mayo del mismo año, el grupo de Stephen Buchwald publicó una extensión del artículo de Migita con dos mejoras importantes sobre la reacción original. En primer lugar, la transaminación de Bu3SnNEt2 seguido de purga con argón para eliminar la dietilamina volátil permitió la extensión de la metodología a diversas aminas secundarias (cíclicas y acíclicas) y anilinas primarias. En segundo lugar, el rendimiento para arenos ricos y pobres en electrones se ha mejorado a través de pequeñas modificaciones en el procedimiento de reacción (mayor carga de catalizador, mayor temperatura, mayor tiempo de reacción), aunque no se incluyeron en esta publicación los grupos arilo orto substituidos.[13]
El año siguiente, estudios comparativos de cada laboratorio mostraron que estos acoplamientos podrían llevarse a cabo con aminas libres en presencia de una base voluminosa (KOtBu en la publicación de Buchwald, LiHMDS en la publicación de Hartwig), lo que permite el acoplamiento sin organoestaño. Aunque estas condiciones mejoradas daban una reacción más rápida, los sustratos se limitaban casi exclusivamente a las aminas secundarias debido a la competencia de la deshidrohalogenación de los bromoarenos.[14][15]
Estos resultados establecieron la llamada "primera generación" de sistemas catalíticos de Buchwald-Hartwig. Los años siguientes vieron el desarrollo de los más sofisticados ligandos fosfina que permiten la extensión a una mayor variedad de aminas y grupos arilo. Los yoduros, cloruros, y triflatos de arilo se convirtieron con el tiempo en sustratos adecuados, y se desarrollaron reacciones con bases más débiles a temperatura ambiente.
Mecanismo editar
El mecanismo de reacción se ha demostrado que procede a través de pasos similares a los conocidos para las reacciones de acoplamiento C-C catalizadas por paladio, a saber, adición oxidante, la formación de amida de paladio (en lugar de transmetalación), y finalmente eliminación reductora. Además de esto, una reacción secundaria improductiva puede competir con la eliminación reductiva en la que se somete a la amida a una beta eliminación para dar el areno deshidrohalogenado y un producto imina.[3]
En el curso del desarrollo de esta reacción, fue complejo determinar qué especie concreta de paladio es responsable de cada uno de estos pasos. Estos estudios han revelado vías de reacción divergentes dependiendo de si se emplean en la reacción ligandos fosfina monodentados o con efecto quelante, y se han revelado diversas influencias (especialmente en relación con los ligandos dialquilbiarilfosfina desarrollados por Buchwald).
El ciclo catalítico transcurre de la siguiente manera:[16][17][18][19]
Enlaces externos editar
- Acoplamiento de Buchwald–Hartwig – Artículos recientes
- Aminación de Buchwald–Hartwig – Protocolos de síntesis en organic-reaction.com
- Química de Buchwald–Hartwig: Encuentro del grupo Ian Mangion MacMillan, 30 de julio de 2002 Enlace
- Reacción de Buchwald-Hartwig. Catalizadores de metales preciosos de Acros Organics para reacciones de acoplamiento en síntesis orgánica Enlace
Referencias editar
- ↑ Surry, D.S.; Buchwald, S.L. (2011), «Dialkylbiaryl phosphines in Pd-catalyzed amination: a user’s guide», Chem. Sci. 2: 27-50, doi:10.1039/c0sc00331j.
- ↑ Hartwig, J.F. (1999), «Approaches to catalyst discovery. New carbon-heteroatom and carbon-carbon bond formation», Pure Appl. Chem 71 (8): 1416-1423.
- ↑ a b Muci, A.R.; Buchwald, S.L. (2002), «Practical Palladium Catalysts for C-N and C-O Bond Formation», Topics in Curr. Chem. 219: 131-209.
- ↑ Hartwig, J.F. (1998), «Carbon-Heteroatom Bond-Forming Reductive Eliminations of Amines, Ethers, and Sulfides», Acc. Chem. Res. 31: 852-860.
- ↑ Wolfe, J.P.; Wagaw, S.; Marcoux, J.F.; Buchwald, S.L. (1998), «Rational Development of Practical Catalysts for Aromatic Carbon-Nitrogen Bond Formation», Acc. Chem. Res. 31: 805-818.
- ↑ Hartwig, J.F. (1998), «Transition Metal Catalyzed Synthesis of Arylamines and Aryl Ethers from Aryl Halides and Triflates: Scope and Mechanism», Angew. Chem. Int. Ed. 37: 2046-2067.
- ↑ Hartwig, J.F., «Evolution of a Fourth Generation Catalyst for the Amination and Thioetherification of Aryl Halides», Acc. Chem. Res. 41 (11): 1534-1544, doi:10.1021/ar800098p.
- ↑ Surry, D.S.; Buchwald, S.L. (2008), «Biaryl Phosphane Ligands in Palladium-Catalyzed Amination», Angew. Chem. Int. Ed. 47: 6338-6361, doi:10.1002/anie.200800497.
- ↑ Hartwig, J.F. (1997), «Palladium-Catalyzed Amination of Aryl Halides: Mechanism and Rational Catalyst Design», Synlett 4: 329-340.
- ↑ Kosugi,M.; Kameyama, M.; Migita, T. (1983), «PALLADIUM-CATALYZED AROMATIC AMINATION OF ARYL BROMIDES WITH N,N-DI-ETHYLAMINO-TRIBUTYLTIN», Chemistry Letters 12 (6): 927-928, doi:10.1246/cl.1983.927.
- ↑ Boger, D.L.; Panek, J.S. (1984), «Palladium(0)- mediated [beta]-carboline synthesis: Preparation of the CDE ring system of lavendamycin», Tetrahedron Letters 25 (30): 3175-3178, doi:10.1016/S0040-4039(01)91001-9.
- ↑ Paul,F.; Patt, J.; Hartwig, J.F. (1994), «Palladium-catalyzed formation of carbon-nitrogen bonds. Reaction intermediates and catalyst improvements in the hetero cross-coupling of aryl halides and tin amides», J. Am. Chem. Soc. 116: 5969-5970, doi:10.1021/ja00092a058.
- ↑ Guram, A.S.; Buchwald, S.L. (1994), «Palladium-Catalyzed Aromatic Aminations with in situ Generated Aminostannanes», J. Am. Chem. Soc. 116 (17): 7901-7902, doi:10.1021/ja00096a059.
- ↑ Louie,J.; Hartwig, J.F. (1995), «Palladium-catalyzed synthesis of arylamines from aryl halides. Mechanistic studies lead to coupling in the absence of tin reagents», Tetrahedron Letters 36 (21): 3609-3612, doi:10.1016/0040-4039(95)00605-C.
- ↑ Guram, A.S.; Rennels, R.A.; Buchwald, S.L. (1995), «A Simple Catalytic Method for the Conversion of Aryl Bromides to Arylamines», Angewandte Chemie International Edition 34 (12): 1348-1350, doi:10.1002/anie.199513481.
- ↑ Driver, M.S.; Hartwig, J.F. (1997), «Carbon−Nitrogen-Bond-Forming Reductive Elimination of Arylamines from Palladium(II) Phosphine Complexes», J. Am. Chem. Soc. 119 (35): 8232-8245, doi:10.1021/ja971057x.
- ↑ Hartwig, J.F.; Richards, S.; Barañano, D.; Paul, F. (1996), «Influences on the Relative Rates for C−N Bond-Forming Reductive Elimination and β-Hydrogen Elimination of Amides. A Case Study on the Origins of Competing Reduction in the Palladium-Catalyzed Amination of Aryl Halides», J. Am. Chem. Soc. 118 (15): 3626-3633, doi:10.1021/ja954121o.
- ↑ Driver, M.S.; Hartwig, J.F. (1995), «A Rare, Low-Valent Alkylamido Complex, a Diphenylamido Complex, and Their Reductive Elimination of Amines by Three-Coordinate Intermediates», J. Am. Chem. Soc. 117 (16 pages = 4708–4709), doi:10.1021/ja00121a030.
- ↑ Widenhoefer, R.A.; Buchwald, S.L. (1996), «Halide and Amine Influence in the Equilibrium Formation of Palladium Tris(o-tolyl)phosphine Mono(amine) Complexes from Palladium Aryl Halide Dimers», Organometallics 15 (12): 2755-2763, doi:10.1021/om9509608.