Chelonoidis chilensis haplogrupo chaco seco
La tortuga terrestre chaqueña (Chelonoidis chilensis haplogrupo chaco seco) es una población genéticamente distinta de tortuga de la familia Testudinidae, que habita en los bosques xerófilos del norte de la Argentina, el oeste del Paraguay y el sudeste de Bolivia.
| Tortuga terrestre chaqueña | ||
|---|---|---|
 Un ejemplar adulto cautivo, que por morfotipo se corresponde con la tortuga terrestre chaqueña (Chelonoidis chilensis ‘haplogrupo chaco seco’). | ||
| Estado de conservación | ||
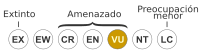 Vulnerable (UICN 3.1)TFTSG Draft | ||
| Taxonomía | ||
| Reino: | Animalia | |
| Filo: | Chordata | |
| Clase: | Sauropsida | |
| Subclase: | Diapsida | |
| Orden: | Testudines | |
| Suborden: | Cryptodira | |
| Familia: | Testudinidae | |
| Género: | Chelonoidis | |
| Especie: |
C. chilensis (Gray 1870) | |
| Subespecie: | Chelonoidis chilensis haplogrupo chaco seco | |
| Distribución | ||
 En color rosado se observa la distribución de la tortuga terrestre chaqueña (Chelonoidis chilensis haplogrupo “chaco seco”). | ||
| Sinonimia | ||
| ||

Distribución y hábitat editar
Es una tortuga característica del Gran Chaco. Se la encuentra por el norte, desde la latitud 19°S en Curuyuqui, departamento de Santa Cruz, en el chaco de Bolivia; siguiendo por el chaco paraguayo y el norte de la Argentina, en las provincias de: Santa Fe —al noroeste—, Chaco —centro y oeste—, Formosa —centro y oeste—, Salta —este—, Tucumán —este—, Santiago del Estero —toda salvo el sudoeste—, Catamarca —extremo este—, y Córdoba —centro y norte—.[2]
Habita en bosques del chaco semiárido. Se adentra en sectores del espinal (distrito del algarrobo). Vive bajo un clima continental, con inviernos secos, con heladas, suaves en el extremo norte y marcadas en el sector sur. Los veranos son lluviosos y muy cálidos, llegando a alcanzar temperaturas próximas a los 50 °C.
Taxonomía editar
Etimología editar
El nombre chilensis hace alusión a Chile, país que no cuenta con ninguna especie de tortuga terrestre. El error se debe a que el colector del ejemplar tipo escribió en la tarjeta de procedencia: Mendoza, Chile, lo cual indujo a la equivocación de John Gray al describirla en 1870, sobre la base de 3 ejemplares provenientes de los alrededores de la ciudad de Mendoza. En ese mismo año, Philip Lutley Sclater al advertir el error geográfico, resolvió modificar el nombre científico proponiendo su reemplazo por la designación argentina, en vez de chilensis. Durante años varios autores continuaron empleando el nuevo nombre, pese a la opinión de Gray en 1872. Posteriormente, por razones nomenclaturales, se empleó en adelante chilensis como nombre exclusivamente válido por la regla de prioridad.
Historia taxonómica editar
Si bien ubicada en distintos géneros, la especie que integra el haplotipo chaco seco fue conocida por más de un siglo como una única especie, mayormente bajo el nombre específico: chilensis, según la descripción original del zoólogo inglés George Robert Gray en 1870 de su Testudo chilensis.[3]
Descripciones de Freiberg editar
En 1973, el herpetólogo argentino Marcos Abraham Freiberg describió dos nuevas especies de este grupo.[4][5]
- Geochelone donosobarrosi: Tortuga endémica del norte patagónico, grande y oscura, con holotipo colectado en San Antonio Oeste, provincia de Río Negro (localidad tipo).
- Geochelone petersi: Característica de los sectores chaqueños más áridos, próximos a salitrales, más pequeña y amarillenta, con holotipo codificado como USNM 192959 d, con localidad tipo en Kishka, La Banda, Santiago del Estero (Argentina), colectado el 5 de mayo de 1971. Los paratipos eran el USNM 192960 5 (misma fecha y localidad) y los FSM Ardiles y IMUP 9 5502, colectados en La Banda, Santiago del Estero el 10 de mayo de 1971. Etimológicamente le dedicaba al doctor James A. Peters, por entonces jefe del departamento de Anfibios y Reptiles del Museo Nacional de Historia Natural del Instituto Smithsoniano, de Washington D. C.
La respuesta de los especialistas fue dispar durante décadas. Algunos tomaron a C. chilensis como sinónimo más antiguo de C. petersi y con dos subespecies, la típica y C. c. donosobarrosi,[6][7] otros dieron por válidas a las 3[8] o solo a C. donosobarrosi y C. chilensis (con C. petersi como una simple variación de esta última),[9][10] mientras que otros autores reconocieron válidas a C. petersi y a C. chilensis (quedando C. donosobarrosi como una simple variación de esta última).[11][12][13] Finalmente, otros consideraron que los caracteres propuestos por Freiberg son altamente variables, por lo tanto carecían de valor diagnóstico, pasando a la sinonimia de C. chilensis sus dos especies.[14]
Esta ambigüedad llevó a E. Richard en 1988 a incluir todas las formas en un complejo de especies: el complejo “C. chilensis”.[15][16]
Para complicar la ya confusa situación,[13] se postuló que el ejemplar tipo empleado por John Edward Gray para describir a la especie Testudo chilensis era del mismo taxón patagónico que un siglo después describiría Freiberg como C. donosobarrosi, el que de este modo cayó en sinonimia del más antiguo chilensis, por lo que, para los que aceptaban como válidas un taxón norpatagónico-cuyano y otro chaqueño, el taxón septentrional quedaba huérfano de nombre, debiéndose emplear el que usó Freiberg para describir esa variación chaqueña pero de una manera más amplia, por lo que el “error” de Freiberg terminaba otorgándole así el nombre válido a la especie del grupo chilensis de la región chaqueña: Chelonoidis petersi (Freiberg, 1973). En la segunda década del siglo XXI, análisis genéticos ayudaron a clarificar la sistemática de estas tortugas.
Diferenciación genética editar
En el año 2012, el profesor Uwe Fritz y colaboradores estudiaron la variabilidad genética del complejo mediante un lote relativamente pequeño de ejemplares (colectados en pocas localidades) a los cuales les fueron extraídos caracteres secuencias del gen mitocondrial citocromo b y 9 microsatélites. Los resultados obtenidos fueron comparados con las distancias genéticas habituales entre las especies válidas dentro de Testudinidae. Se detectaron genéticamente dos grupos, uno en el centro y norte de Argentina, y el otro en la Patagonia, aunque con baja diferenciación, por lo que concluyeron que el único taxón válido del complejo es C. chilensis siendo sinónimos juniors de este C. petersi y C. donosobarrosi.
Su hipótesis biogeográfica es que C. chilensis se originó en un ancestro que ocupó una gran área geográfica similar a la actual. Las poblaciones australes no soportaron las nuevas condiciones ambientales ocurridas durante el Plio-Pleistoceno, por lo que la especie se extinguió de la Patagonia. Durante el Holoceno, partiendo desde las poblaciones del oeste argentino, la especie habría vuelto a sus territorios patagónicos, alcanzado la región dispersándose mediante flotación (“rafting”), derivando hacia el sur por la ruta biológica conformada por el impresionante caudal postglaciación del río Desaguadero.[17]
Al poco tiempo, la licenciada Julieta Sánchez realizó un trabajo de tesis sobre la variabilidad genética de esta tortuga, tanto la constitución cromosómica como molecular, con la aplicación de métodos de coalescencia y el estudio de su distribución geográfica y morfotipos en que el animal se manifiesta.[18] Para ello empleó 98 especímenes colectados en todo su rango de distribución, de las cuales se obtuvo 92 muestras de las cuales en 69 de ellas se logró amplificar el gen del citocromo b. Como resultado logró describir 11 nuevos haplotipos (C2, C3, C6, C14, C15, C16, C17, C18, C19, C20 y C21).[18]
Su análisis de las relaciones filogenéticas mostró la existencia de 2 haplogrupos bien sustentados por los 3 métodos utilizados: Máxima Parsimonia, Máxima Verosimilitud e Inferencia Bayesiana.[18] Estos haplogrupos fueron denominados “Haplogrupo Chaco Seco” y “Haplogrupo del Monte”. En el análisis del ADNmt, al primero le corresponden mitocondrialmente tortugas con Cariomorfo A, las que habitan en la región chaqueña occidental. Al segundo le corresponden individuos del Cariomorfo B, y se distribuyen en la ecorregión del monte.[18] Por medio de parsimonia estadística se obtuvo una red que presentó entre ambos haplotipos 10 pasos mutacionales de separación. La divergencia genética entre ambos grupos fue del 1,3 %, según la autora, insuficiente para la consideración de ambos como sendas especies plenas,[18] aunque sus rasgos genéticos avalan tratarlas en estrategias de conservación por lo menos como distintas «unidades evolutivas significativas» (UES).[19]
A pesar de la diferencia en el tamaño, la especie posee menor distancia genética con el complejo que integran las tortugas de las Galápagos (9,1 %),[18] siendo mayor la diferenciación con las otras especies del género Chelonoidis del subcontinente sudamericano: el morrocoy sabanero (13,4 %) y el morrocoy de la selva (13,1 %).[18] Si se utiliza una tasa de sustitución nucleotídica similar a la que ocurre en otros quelonios para cotejar la diferencia entre los dos haplogrupos de C. chilensis,[20][21] la divergencia encontrada implica un mínimo de 100 000 años de separación entre sí.
Esta variabilidad genética detectada en C. chilensis fue explicada en razón de un evento vicariante causado por los cambios climáticos de fines del Mioceno y Plio-Pleistoceno, los que al primigenio stock continúo inicial pre Mioceno del reptil, le ocasionaron un hiato suficientemente amplio en la parte central de la geonemia, aislando la población septentrional de la austral, las que evolucionaron de forma separada produciendo dentro de la misma especie dos cariomorfos.[18] Estos cambios climáticos fueron acompañados con el levantamiento de la cordillera de los Andes, lo que causó una marcada aridez en la llanura patagónica, y posteriormente un descenso de la temperaturas (con un notable avance glaciar desde el sur), que terminó por extinguir a los quelonios de la Patagonia austral, pero estas adversidades no fueron lo suficientemente intensas para extinguir a la población de esta tortuga de la Patagonia norte, la que logró resistir.
El posible refugio donde habría sobrevivido y se habría reordenado cromosómicamente la población que conformaría luego el haplotipo del monte fue postulado como situado en el área mesopotámica comprendida entre los ríos pre-Colorado y pre-Negro.[9] Este patrón biogeográfico también fue propuesto para otros grupos de reptiles norpatagónicos.[22][23][24][25] Posteriormente, ante nuevos cambios climáticos la población austral se expandió demográficamente por el área central.[26][27][28][29]
Esta expansión hacia el norte del haplotipo del monte concluyó al contactar secundariamente con el cariotipo C13 que representaría una leve expansión austral del haplotipo chaco seco, efectuando el solapamiento en zonas al norte de la Salina Grande del sudeste de Catamarca, en la salina de Ambargasta en la parte sur de Santiago del Estero y quizás en el norte de Córdoba. Estas zonas fueron ambientalmente fragmentadas y las poblaciones de tortugas que allí habitaban fueron diezmadas por la explotación para satisfacer el comercio de mascotas desde la década de 1960, con un máximo en la década de 1980.[30][18]
Características editar
La morfología carapacial para la especie fue definida tradicionalmente mediante la existencia de 3 morfotipos. De estos, en la población del “haplotipo chaco seco” es posible encontrar a los 3, siendo uno de ellos (el morfotipo “petersi”) exclusivo de este haplotipo.
- Morfotipo “petersi”
Este morfo, exclusivo del haplotipo chaqueño, es el de menor tamaño de la especie; su carapacho usualmente no supera los 21 cm en las hembras y 17 cm en los machos. Es de tono general amarillento; las placas son lisas y, en especial las del plastrón, carecen completamente de grabado. El pico es bicuspídeo con borde denticulado. Este morfotipo es más frecuente en arenales muy secos y áreas en derredor de salinas.
- Morfotipo “chilensis”
Este morfotipo es mayor que el precedente y menor que el siguiente. Dorsalmente tiene las placas unidas por bandas negras, las que están conformadas por anillos de crecimiento bien marcados, mostrando color amarillento en el centro de las mismas. El pico es tricuspídeo. El morfotipo “chilensis”, si bien no le es privativo, responde en general al más característico para la región chaqueña.
- Morfotipo “donosobarrosi”
Este morfotipo es más habitual en las tortugas del “haplotipo del monte”, siendo más raro en el “haplotipo chaco seco”. Exhibe ejemplares de gran tamaño, de coloración general oscura, con caparazón deprimido (especialmente los machos); dorsalmente gris pizarra.
El caparazón presenta el borde escotado y arqueado hacia arriba, en especial en la parte anterior; marginales grabadas, que en su unión forman ángulos; sexta marginal levemente más larga que alta; las placas dorsales en su periferia son grabadas, claras y opacas, pero poseen un centro bien amplio, de textura lisa y de coloración negra brillante. Las placas centrales son más anchas que largas y, al menos la última, de igual anchura que las laterales.
El plastrón es pardo-amarillento uniforme, con las placas fuertemente grabadas mediante crestas paralelas a las suturas. El cuello, la cabeza y las patas poseen color grisáceo oscuro, estas últimas con fuertes escamas tuberculadas córneas y cónicas, las que son notablemente prominentes y de gran desarrollo en los miembros anteriores, formando una coraza articulada. En la cabeza, las 2 grandes escamas prefrontales y una frontal pequeña –esta generalmente dividida- no se diferencian de las restantes escamas, siendo rugosas. El pico es bicuspídeo, con denticulado en el borde. El lóbulo anterior es más angosto que el posterior, con su ancho más corto que el puente de unión entre el caparazón y el plastrón. El borde anterior está poco escotado y el posterior mucho más, hasta adquirir dos puntas agudas separadas por un amplio arco cóncavo. La sutura interhumeral es equivalente a la mitad de la sutura abdominal. La pectoral es estrecha en su parte media, ensanchándose hacia afuera, donde mide 3 veces más. Sutura intergular mayor que la interpectoral e interanal.
Costumbres editar
- Alimentación
Se alimenta de frutos silvestres,gramíneas, y cactáceas.
- Hábitos
Es diurna; camina en búsqueda de alimento en buena parte del día, aunque en las horas más calurosas del verano se oculta a la sombra de arbustos.
Los ejemplares del “haplotipo chaco seco”, en razón de vivir bajo condiciones climáticas con temperaturas invernales relativamente benignas, como respuesta eco-etológica para realizar el sopor invernal se limitan a refugiarse en pequeñas oquedades bajo arbustos, bajo matas de caraguatáes u otras plantas, es decir, no construyen cuevas-refugio, o si las hacen estas son muy poco profundas. Esto las diferencia de las tortugas del “haplotipo del monte”, las que, dado que habitan mayormente en climas con inviernos rigurosos, bruman dentro de profundas cuevas.[31][32]
- Predadores
Estas tortugas son predadas por aves rapaces, felinos, zorros, y grandes lagartos.
Las tortugas del “haplotipo chaco seco” sufren habitualmente ectoparásitos: garrapatas de tres especies del género Amblyomma, especialmente Amblyoma argentinae[33][34] (lo que en un principio se postuló como diagnóstico de especificidad).[35]
- Reproducción
En noviembre y diciembre se produce el acto sexual (cópulas), luego de combates entre los machos para dominar las hembras de su territorio. Entre enero y marzo, la hembra excava con sus patas traseras, un nido a 10 cm de profundidad, y allí deposita de 1 a 4 huevos circulares blancos, de unos 40 mm de diámetro. Las puestas de este tipo son hasta 3 por temporada, con un intervalo entre ellas de 30 días. Las crías nacen luego de una incubación de 12 a 14 meses, midiendo de 34 a 42 mm y pesando de 15 a 20 g.
Conservación editar
Las poblaciones de tortugas del “haplogrupo chaco seco” están incluidas, como todas las de la especie, en el Apéndice II de la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora (CITES). Las comisiones de conservación de la Unión Internacional para la Conservación de la Naturaleza (UICN) las consideran como «Vulnerables». Como resultado de un intenso estudio poblacional de la especie se ha propuesto que su grado de peligro debería ser “amenazada”,[18] elevándolo de este modo desde el considerado como “vulnerable”.[36][37]
Fue capturada con fines alimenticios por las primitivas etnias aborígenes que compartieron su distribución. Modernamente, hacen lo propio habitantes rurales o puesteros, para aprovechar su carne y grasa, sobre la base de recetas heredadas oralmente con una importante diversificación.
La transformación de su hábitat natural para ser reconvertido en tierras agrícolas es el principal problema que las aqueja. Las mayores tasas de desmonte en la Argentina, Bolivia y Paraguay se están produciendo en áreas chaqueñas donde esta tortuga vive.
Si bien la tenencia, transporte y comercio de las tortugas terrestres argentinas está prohibido por ley, el tráfico continúa, por lo que, unido a la prolongada vida que suelen tener en cautiverio, siguen todavía siendo frecuentes mascotas de los domicilios del país.[38] La explotación se centra fundamentalmente en las tortugas pequeñas del “haplogrupo chaco seco”, siendo marginal o local la captura de ejemplares del “haplogrupo monte”.
Las poblaciones de C. chilensis que son mantenidas en zoológicos, unidades de rescate de fauna y centros de acopio deberían ser divididas en dos grupos según a qué haplogrupo representan teniendo en cuenta fundamentalmente sus rasgos genéticos cariotípicos y no solo sobre la base de su expresión fenotípica, para de este modo evitar posibles hibridaciones entre individuos de haplotipos distintos o introducciones de ejemplares en las geonemias no correspondientes a su respectivo haplotipo.[18][39]
Véase también editar
Referencias editar
- ↑ TFTSG, 2010. Turtles of the World, Update:Annotated Checklist of Taxonomy, Synonymy, Distribution, and Conservation Status (Checklist 000v3) pág. 117
- ↑ Chébez, J.C. (2008). Los que se van. Fauna argentina amenazada. 320 pp. Ed. Albatros, Buenos Aires, Argentina.
- ↑ Gray J. E. (1870). Notes on three species of tortoises living in the Society´s Gardens. Proc. Zool. Soc.: 706-708.
- ↑ Freiberg M. A. (1973). Dos nuevas tortugas terrestres de Argentina. Bol. Soc. Biol. Concepción 46: 81-93.
- ↑ Freiberg M. A. (1979). El mundo de las tortugas (2º ed.). Ed. Albatros. 154 pp. Argentina.
- ↑ Ernst C. H. and Barbour R. W. (1989). Turtles of the world. Smithsonian Institution Press, Washington D.C., and London, 313 pp.
- ↑ Pritchard P. C. H. (1979). Encyclopaedia of turtles. TFH Publications, Ney Yersey, USA, 895 pp.
- ↑ Cei J. M. (1986). Reptiles del centro, centro-oeste y sur de la Argentina. Herpetofauna de las zonas áridas y semiáridas. Torino, Mus. Reg. Sci. Natur. Torino, Monogr. IV: 1-527.
- ↑ a b Richard E. (1999). Tortugas de las regiones áridas de Argentina. Buenos Aires, L.O.L.A., Nº10, 200 pp., 8 pls.
- ↑ Cei J. M. (1993). Reptiles del Noroeste, Nordeste y Este de la Argentina. Herpetofauna de las selvas subtropicales, Puna y Pampas. Torino, Mus. Reg. Sci. Natur. Torino, Monogr. XIV: 1-949.
- ↑ Buskirk J. R. (1993). Distribution, status and biology of the tortoise, Geochelone chilensis, in Río Negro Provence, Argentina. Stud. Neotrop. Fauna Environ. 28: 233-249.
- ↑ Fernández, Marta Susana (1988). Las testudinidae [Reptilia: Chelonii] argentinas. Osteología, sistemática y distribución geográfica Directores: Brandoni de Gasparini, Zulma Nélida; Lanteri, Analía Alicia. La Plata: Universidad Nacional de La Plata. Facultad de Ciencias Naturales y Museo, Tesis nº: 0517.
- ↑ a b Cabrera, M. R. (1998). Las tortugas continentales de Sudamérica. Edición del autor. 108 pág.
- ↑ Wermuth, H., & Mertens, R. (1977). Liste der rezenten Amphibien und Reptilien.-Testudines, Crocodylia, Rhynchocephalia. Berlin, New York.
- ↑ Richard E. (1988). Las “Yatache” (Chelonoidis donosobarrosi: Chelonii, Testudinidae) de la región del Nevado (Mendoza: Argentina). Apuntes sobre su historia natural. FVSA, Amphibia y Reptilia (conservación) 1: 79-92.
- ↑ Richard E. (1988). Notas ecoetológicas sobre las tortugas del complejo chilensis (Chelonii: Testudinidae) II. Litofagía y geofagía. Boletín de la Asociación Herpetológica de Argentina 4: 12.
- ↑ Fritz U., Alcalde L., Vargas-Ramírez M., Goode E., Fabius-Turoblin D. U. and Praschag, P. (2012). Northern genetic richness and southern purity, but just one species in the Chelonoidis chilensis complex. Zoologica Scripta 41: 220-232.
- ↑ a b c d e f g h i j k Sánchez, Julieta (2012). Variabilidad genética, distribución y estado de conservación de las poblaciones de Tortugas terrestres Chelonoidis chilensis (Testudines: Testudinidae) que habitan en la República Argentina. Director de Tesis: Dr. Alejandro Daniel Bolzán. Codirector de Tesis: Dr. Leandro Alcalde. Lugar de trabajo: Instituto Multidisciplinario de Biología Celular (IMBICE) CCT-CONICET La Plata – CICPBA. Facultad de Ciencias Naturales y Museo de la Universidad Nacional de La Plata.
- ↑ Waples, R. S. (1995). Evolutionarily significant units and the conservation of biological diversity under the Endangered Species Act. In American Fisheries Society Symposium (Vol. 17, pp. 8-27).
- ↑ Starkey D. E., Shaffer H. B., Burke R. L., Forstner M. R. J. et al. (2003). Molecular systematic, phylogeography, and the effects of Pleistocene glaciations in the painted turtle (Chysemys picta) complex. Evolution 57:119-128.
- ↑ González-Porter G. P., Hailer F., Flores-Villela O., García-Anleu R. & Maldonado J. E. (2011). Patterns of genetic diversity in the critically endangered Central American river turtle: human influence since the Mayan age? Conservation Genetics 12: 1229-1242.
- ↑ Cei J. M. & Scolaro J. A. (1982). A population of Tupinambis from northern Patagonia, South Río Negro River. Herpetological Review 13:1-26.
- ↑ Ávila L. J., Morando M. and Sites J. W. jr. (2006). Congeneric phylogeography: hypothesizing species limits and evolutionary processes in Patagonian lizards of the Liolaemus boulengeri group (Squamata: Liolaemini).Biological Journal of the Linnean Society 89: 241-275.
- ↑ Albino A. M. (2011). Evolution of Squamata reptiles in Patagonia base on the fossil record. Biological Journal of the Linnean Society 103: 441-457.
- ↑ Albino A. M., Brizuela S. & Montalvo C. I. (2006). New Tupinambis remains from the Late Mioceno of Argentina and a review of the South American miocene Teiids. Journal of Herpetology 40: 206-213.
- ↑ Templeton A. R., Routman E. & Phillips C. A. (1995). Separating population structure from population history: A cladistic analysis of the geographical distribution of mitochondrial DNA haplotypes in the Tiger Salamander, Ambystoma tigrinum. Genetics 140: 767-782.
- ↑ Avise J. C. (2000). Phylogeography: the history and formation of species. Harvard University Press, Cambridge (MA).
- ↑ González-Porter G. P., Hailer F., Flores-Villela O., García-Anleu R. & Maldonado J. E. (2011). Patterns of genetic diversity in the critically endangered Central American river turtle: human influence since the Mayan age? Conservation Genetics 12: 1229-1242.
- ↑ Teacher A. G. F., Thomas J. A. & Barnes I. (2011). Modern and ancient red fox (Vulpes vulpes) in Europe show an unusual lack of geographical and temporal structuring, and differing responses within the carnivores to historical climatic change. BMC Evolutionary Biology 11: 214.
- ↑ Waller T. and Micucci P. (1997). Land use and grazing in relation to the genus Geochelone in Argentina. Proceedings: Conservation, Restoration, and Management of Tortoises and Turtles - An International Conference, pp 2-9.
- ↑ Auffenberg W. (1969). Land of the Chaco tortoise, Geochelone chilensis. International Turtle and Tortoise Society Journal 3: 1-6.
- ↑ Gallardo, J. M. (1974). Tortugas terrestres argentinas: Observaciones biológicas. Ciencia e Investigación 30: 197-201.
- ↑ Guglielmone, A. A. & Nava, S. (2006). Las garrapatas argentinas del género Amblyomma (Acari: Ixodidae), distribución y hospedadores. RIA (INTA, Argentina) 35: 133-153.
- ↑ Guglielmone A. A., Luciani C. A. & Magnold A. J. (2001). Aspects of the ecology of Amblyomma argentinae Neumann, 1904 [=Amblyomma testudinis (Connil 1877)] (Acari: Ixodidae). Systematic and Applied Acarology Special Publications 8: 1-12.
- ↑ Richard E. & Guglielmone A. (1988). Análisis preliminar de la relación entre el parásito Amblyomma testudinis (Acarii: Ixodidae) y las tortugas del complejo chilensis (Chelonii: Testudinidae). I. Importancia en la discriminación específica de Chelonoidis chilensis y Chelonoidis donosobarrosi. Bol. Asoc. Herp. Arg., 4 (2-3): 12. La Plata. ISSN 0326-5544.
- ↑ Richard E. & Waller T. (2000). Categorización de las tortugas de Argentina. Capítulo 3, pags 35-44. En: Lavilla, E. O., Richard, E. & Scrochi, G. J. eds. Categorización de los anfibios y reptiles de la República Argentina. Asociación Herpetológica Argentina, 97 pp.
- ↑ Prado W. S., Waller T., Piña C. A., Albareda D. A., Cabrera M. R., Etchepare E., Giraudo A., González Carman V., Prosdocimi L. & Richard E. (2012). Categorización del estado de conservación de las Tortugas y Caimanes de la República Argentina. Cuadernos de Herpetología.
- ↑ Gruss J. X. (1986). Geochelone chilensis en cautividad, descripción. FVSA - Amphibia & Reptilia (cons.) 1: 29-31.
- ↑ Bueno M. L. (2003). Importancia de la caracterización genética de especies silvestres en zoológicos, unidades de rescate de fauna y centros de acopio. Lyonia 3: 45-56.