Enlace metálico
Un enlace metálico es un enlace químico que mantiene unidos los átomos (Unión entre núcleos atómicos y los electrones de valencia, que se juntan alrededor de estos como una nube) de los metales entre sí.

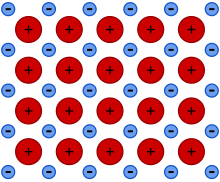
Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras muy compactas. Se trata de líneas tridimensionales que adquieren estructuras tales como: la típica de empaquetamiento compacto de esferas (hexagonal compacta), cúbica centrada en las caras o la cúbica centrada en el cuerpo.
En este tipo de estructura cada átomo metálico está rodeado por otros doce átomos[1] (seis en el mismo plano, tres por encima y tres por debajo). Además, debido a la baja electronegatividad que poseen los metales, los electrones de valencia son extraídos de sus orbitales. Este enlace sólo puede estar en sustancias en estado sólido.[2]
Los metales poseen algunas propiedades características que los diferencian de los demás materiales. Suelen ser sólidos a temperatura ambiente, excepto el mercurio, que tienen un punto de fusión muy bajo.
El enlace metálico es característico de los elementos metálicos. Es un enlace fuerte, primario, que se forma entre elementos de la misma especie. Al estar los átomos tan cercanos unos de otros, interaccionan sus núcleos junto con sus nubes electrónicas, empaquetándose en las tres dimensiones, por lo que quedan los núcleos rodeados de tales nubes. Estos electrones libres son los responsables de que los metales presenten una elevada conductividad eléctrica y térmica, ya que estos se pueden mover con facilidad si se ponen en contacto con una fuente eléctrica. Los metales generalmente presentan brillo y son maleables.
Los elementos con un enlace metálico están compartiendo un gran número de electrones de valencia, formando un mar de electrones rodeando un enrejado gigante de cationes.[3]
Muchos de los metales tienen puntos de fusión más altos que otros elementos no metálicos, por lo que se puede inferir que hay enlaces más fuertes entre los distintos átomos que los componen.
La vinculación metálica es no polar, apenas hay diferencia de electronegatividad entre los átomos que participan en la interacción de la vinculación (en los metales, elementales puros) o muy poca (en las aleaciones), y los electrones implicados en lo que constituye la interacción a través de la estructura cristalina del metal. El enlace metálico explica muchas características físicas de metales, tales como solidez, dureza, maleabilidad, ductilidad, buenos en la conducción de calor y electricidad, y con brillo o lustre (devuelven la mayor parte de la energía lumínica que reciben).[4][5][6][7]
La vinculación metálica es la atracción electrostática entre los átomos del metal o cationes y los electrones deslocalizados. Esta es la razón por la cual se puede explicar un deslizamiento de capas, dando por resultado su característica maleabilidad y ductilidad.
Los átomos del metal tienen por lo menos un electrón de valencia, no comparten estos electrones con los átomos vecinos, ni pierden electrones para formar los iones. En su lugar los niveles de energía externos de los átomos del metal se traslapan. Son como enlaces covalentes identificados.
Historia editar
A medida que la química se desarrollaba como ciencia, quedó claro que los metales formaban la mayor parte de la tabla periódica de los elementos, y se hicieron grandes progresos en la descripción de las sales que pueden formarse en reacciones con ácidos. Con el advenimiento de la electroquímica, quedó claro que los metales generalmente entran en solución como iones cargados positivamente, y las reacciones de oxidación de los metales se comprendieron bien en sus series electroquímicas. Surgió una imagen de los metales como iones positivos unidos por un océano de electrones negativos.
Con el advenimiento de la mecánica cuántica, esta imagen recibió una interpretación más formal en forma del modelo de electrón libre y su extensión posterior, el modelo del electrón casi libre. En ambos modelos, los electrones se ven como un gas que viaja a través de la estructura del sólido con una energía que es esencialmente isótropa, en el sentido de que depende del cuadrado de la magnitud, no de la dirección del vector momento k. En el espacio k tridimensional, el conjunto de puntos de los niveles llenos más altos (la superficie de Fermi) debería ser, por tanto, una esfera. En el modelo casi libre, la Zona de Brillouin en forma de caja se añaden al espacio k por el potencial periódico experimentado por la estructura (iónica), rompiendo así ligeramente la isotropía.
La llegada de la difracción de rayos X y el análisis térmico permitió estudiar la estructura de los sólidos cristalinos, incluidos los metales y sus aleaciones, y se desarrollaron los diagramas de fase. A pesar de todos estos avances, la naturaleza de los compuestos intermetálicos y las aleaciones seguía siendo en gran medida un misterio y su estudio era a menudo meramente empírico. Por lo general, los químicos se apartaban de todo lo que no pareciera seguir la leyes de las proporciones múltiples de Dalton; y el problema se consideraba del dominio de una ciencia diferente, la metalurgia.
El modelo de electrones casi libres fue adoptado con entusiasmo por algunos investigadores en este campo, en particular Hume-Rothery, en un intento de explicar por qué se formaban ciertas aleaciones intermetálicas con determinadas composiciones y otras no. Al principio, los intentos de Hume-Rothery tuvieron bastante éxito. Su idea consistía en añadir electrones para inflar el globo esférico de Fermi dentro de la serie de cajas de Brillouin y determinar cuándo se llenaría una caja determinada. Esto predijo un número bastante grande de composiciones de aleaciones que se observaron más tarde. Tan pronto como la resonancia ciclotrónica estuvo disponible y se pudo determinar la forma del globo, se descubrió que la suposición de que el globo era esférico no se cumplía, excepto quizás en el caso del cesio. Este hallazgo redujo muchas de las conclusiones a ejemplos de cómo un modelo puede a veces dar toda una serie de predicciones correctas, y aun así estar equivocado.
La debacle de los electrones casi libres mostró a los investigadores que cualquier modelo que supusiera que los iones se encontraban en un mar de electrones libres necesitaba modificaciones. Así, se desarrollaron varios modelos de mecánica cuántica, como los cálculos de estructura de bandas basados en orbitales moleculares o la teoría del funcional de la densidad. En estos modelos, se parte de los orbitales atómicos de los átomos neutros que comparten sus electrones o (en el caso de la teoría funcional de la densidad) se parte de la densidad electrónica total. No obstante, la imagen del electrón libre ha seguido siendo la dominante en la enseñanza.
El modelo de estructura de bandas electrónicas se convirtió en uno de los principales focos de atención no sólo para el estudio de los metales, sino aún más para el estudio de los semiconductores. Junto con los estados electrónicos, se demostró que los estados vibracionales también formaban bandas. Rudolf Peierls demostró que, en el caso de una fila unidimensional de átomos metálicos -por ejemplo, hidrógeno-, tenía que surgir una inestabilidad que condujera a la ruptura de dicha cadena en moléculas individuales. Esto despertó el interés por la pregunta general: ¿cuándo es estable el enlace metálico colectivo y cuándo ocupará su lugar una forma más localizada de enlace? Se investigó mucho el estudio de la agrupación de átomos metálicos.
A pesar de que el concepto de modelo de estructura de bandas ha demostrado ser muy útil para describir la unión metálica, tiene el inconveniente de que sigue siendo una aproximación de un solo electrón a un problema de muchos cuerpos. En otras palabras, los estados energéticos de cada electrón se describen como si todos los demás electrones formaran simplemente un fondo homogéneo. Investigadores como Mott y Hubbard se dieron cuenta de que esto era quizás apropiado para electrones s- y p fuertemente deslocalizados; pero para electrones d, y aún más para electrones f, la interacción con electrones (y desplazamientos atómicos) en el entorno local puede llegar a ser más fuerte que la deslocalización que conduce a bandas anchas. Así, la transición de los electrones no apareados localizados a los itinerantes que participan en el enlace metálico se hizo más comprensible.
La naturaleza del enlace metálico editar
La combinación de dos fenómenos da lugar al enlace metálico: deslocalización de electrones y la disponibilidad de un número mucho mayor de estados energéticos deslocalizados que de electrones deslocalizados.[aclaración requerida] Esto último podría denominarse deficiencia de electrones.
En 2D editar
El grafeno es un ejemplo de enlace metálico bidimensional. Sus enlaces metálicos son similares a enlace aromático en benceno, naftaleno, antraceno, ovaleno, etc.
En 3D editar
La aromaticidad metálica en cúmulos metálicos es otro ejemplo de deslocalización, esta vez a menudo en disposiciones tridimensionales. Los metales llevan el principio de deslocalización a su extremo, y se podría decir que un cristal de un metal representa una única molécula sobre la que todos los electrones de conducción están deslocalizados en las tres dimensiones. Esto significa que, por lo general, en el interior del metal no se distinguen las moléculas, por lo que el enlace metálico no es ni intramolecular ni intermolecular. Quizá sería mejor hablar de "no molecular". El enlace metálico es mayoritariamente apolar, porque incluso en las aleaciones hay poca diferencia entre las electronegatividades de los átomos que participan en la interacción de enlace (y, en los metales elementales puros, ninguna en absoluto). Por lo tanto, el enlace metálico es una forma comunal extremadamente deslocalizada de enlace covalente. En cierto sentido, el enlace metálico no es un tipo de enlace "nuevo". Describe el enlace sólo como presente en un trozo de materia condensada: ya sea sólido cristalino, líquido o incluso vidrio. Los vapores metálicos, por el contrario, suelen ser atómicos (Hg) o a veces contienen moléculas, como Na2, unidas por un enlace covalente más convencional. Por eso no es correcto hablar de un único "enlace metálico".[aclaración requerida]
La deslocalización es más pronunciada para los electrones s- y p. La deslocalización en el cesio es tan fuerte que los electrones están virtualmente liberados de los átomos de cesio para formar un gas limitado sólo por la superficie del metal. Para el cesio, por lo tanto, la imagen de iones Cs+ unidos por un gas de electrones cargado negativamente no es inexacta.[9] Para otros elementos los electrones son menos libres, en el sentido de que todavía experimentan el potencial de los átomos metálicos, a veces con bastante fuerza. Requieren un tratamiento mecánico cuántico más intrincado (por ejemplo, enlace estrecho) en el que los átomos se consideran neutros, como los átomos de carbono en el benceno. Para los electrones d- y especialmente f- la deslocalización no es fuerte en absoluto y esto explica por qué estos electrones son capaces de seguir comportándose como electrones no apareados que conservan su espín, añadiendo interesantes propiedades magnéticas a estos metales.
Deficiencia y movilidad de electrones editar
Los átomos metálicos contienen pocos electrones en sus Conchas de valencia en relación con sus periodos o nivel de energías. Son deficiencias de electrones en relación con su nivel de energía. Son elementos deficientes en electrones y el reparto comunal no cambia esta situación. Quedan muchos más estados energéticos disponibles que electrones compartidos. Por tanto, se cumplen ambos requisitos para la conductividad: fuerte deslocalización y bandas de energía parcialmente llenas. Por tanto, estos electrones pueden cambiar fácilmente de un estado energético a otro ligeramente distinto. Así, no sólo se deslocalizan, formando un mar de electrones que impregna la estructura, sino que también son capaces de migrar a través de la estructura cuando se aplica un campo eléctrico externo, lo que da lugar a la conductividad eléctrica. Sin el campo, los electrones se mueven por igual en todas direcciones. Dentro de dicho campo, algunos electrones ajustarán ligeramente su estado, adoptando un vector de onda diferente. En consecuencia, habrá más electrones moviéndose en una dirección que en otra y se producirá una corriente neta.
La libertad de los electrones para migrar también da a los átomos metálicos, o a capas de ellos, la capacidad de deslizarse unos sobre otros. Localmente, los enlaces pueden romperse fácilmente y sustituirse por otros nuevos tras una deformación. Este proceso no afecta demasiado al enlace metálico comunal, lo que da lugar a la maleabilidad y ductilidad características de los metales. Esto es especialmente cierto en el caso de los elementos puros. En presencia de impurezas disueltas, las escisiones que normalmente se forman con facilidad pueden bloquearse y el material endurecerse. El oro, por ejemplo, es muy blando en estado puro (24-karat), por eso se prefieren las aleaciones en joyería.
Los metales también suelen ser buenos conductores del calor, pero los electrones conductores sólo contribuyen en parte a este fenómeno. Las vibraciones colectivas (es decir, deslocalizadas) de los átomos, conocidas como fononess que viajan a través del sólido como una onda, contribuyen en mayor medida.
Sin embargo, una sustancia como el diamante, que conduce bastante bien el calor, no es un conductor eléctrico. Esto no es consecuencia de que la deslocalización esté ausente en el diamante, sino simplemente de que el carbono no es deficiente en electrones.
La deficiencia de electrones es importante para distinguir el enlace metálico del enlace covalente más convencional. Por lo tanto, deberíamos modificar la expresión anterior por: El enlace metálico es una forma comunal extremadamente deslocalizada de deficiencia de electrones[10] enlace covalente.
Teoría del gas electrónico editar
Estas propiedades se deben al hecho de que los electrones exteriores están ligados sólo «ligeramente» a los átomos, formando una especie de gas (también llamado «gas electrónico», «nube electrónica», «mar de electrones» o «mar electrónico»), que se conoce como enlace metálico. Drude y Lorentz, propusieron este modelo hacia 1900.[11]
En definitiva, un elemento metálico se considera que está constituido por cationes metálicos distribuidos regularmente e inmersos en un «gas electrónico» de valencia deslocalizados, actuando como un aglutinante electrostático que mantiene unidos a los cationes metálicos.
El modelo del «gas electrónico» permite una explicación cualitativa sencilla de la conductividad eléctrica y térmica de los metales. Dado que los electrones son móviles, se pueden trasladar desde el electrodo negativo al positivo cuando el metal se somete al efecto de una diferencia de potencial eléctrico. Los electrones móviles también pueden conducir el calor transportando la energía cinética de una parte a otra del cristal. El carácter dúctil y maleable de los metales está permitido por el hecho de que el enlace deslocalizado se extiende en todas las direcciones; es decir, no está limitado a una orientación determinada, como sucede en el caso de los sólidos de redes covalentes.
Cuando un cristal metálico se deforma, no se rompen enlaces localizados; en su lugar, el mar de electrones simplemente se adapta a la nueva distribución de los cationes, siendo la energía de la estructura deformada similar a la original. La energía necesaria para deformar un metal como el litio es relativamente baja, siendo, como es lógico, mucho mayor la que se necesita para deformar un metal de transición, porque este último posee muchos más electrones de valencia que son el aglutinante electrostático de los cationes.
Mediante la teoría del «gas electrónico» se pueden justificar de forma satisfactoria muchas propiedades de los metales, pero no es adecuada para explicar otros aspectos, como la descripción detallada de la variación de la conductividad entre los elementos metálicos.
Radio metálico editar
El radio metálico se define como la mitad de la distancia entre los dos iones metálicos adyacentes en la estructura metálica. Este radio depende de la naturaleza del átomo, así como de su entorno, específicamente, del número de coordinación (CN), que a su vez depende de la temperatura y la presión aplicada.
Al comparar tendencias periódicas en el tamaño de los átomos, a menudo es deseable aplicar la llamada corrección de Goldschmidt, que convierte los radios atómicos a los valores que tendrían los átomos si estuvieran coordinados en 12. Dado que los radios metálicos son mayores para el número de coordinación más alto, la corrección para coordinaciones menos densas implica multiplicar por x, donde 0 < x < 1. Específicamente, para CN = 4, x = 0,88; para CN = 6, x = 0,96 y para CN = 8, x = 0,97. La corrección lleva el nombre de Victor Goldschmidt, quien obtuvo los valores numéricos citados anteriormente.[12]
Los radios siguen las tendencias periódicas generales: disminuyen a lo largo del período debido al aumento de la carga nuclear efectiva, que no se compensa con el aumento del número de electrones de valencia; pero los radios aumentan hacia abajo en el grupo debido a un aumento en el número cuántico principal. Entre los elementos 4d y 5d, se observa la contracción de los lantánidos: hay un aumento muy pequeño del radio hacia abajo del grupo debido a la presencia de orbitales f de blindaje.
Referencias editar
- ↑ Chemical Bond Approach project. Reverte. Consultado el 14 de noviembre de 2018.
- ↑ Zarcero, Félix García; Francisca, Manteca Reverte; Ed.), Otras menciones: Olmedo González, Juan Antonio (Coord (2010). Física y química. 1º bachillerato. Ministerio de Educación. ISBN 9788436949179. Consultado el 2 de febrero de 2018.
- ↑ Atkins, Peter; Jones, Loretta (2006). Principios de química: los caminos del descubrimiento. Ed. Médica Panamericana. ISBN 9789500600804. Consultado el 2 de febrero de 2018.
- ↑ Metallic bonding. chemguide.co.uk
- ↑ Metal structures. chemguide.co.uk
- ↑ Chemical Bonds. chemguide.co.uk
- ↑ "Physics 133 Lecture Notes" Spring, 2004. Marion Campus. physics.ohio-state.edu
- ↑ Okumura, K.; Templeton, I. M. (1965). «La superficie de Fermi del cesio». Proceedings of the Royal Society of London A 287 (1408): 89-104. Bibcode:1965RSPSA.287...89O. JSTOR 2415064. S2CID 123127614.
- ↑ Si los electrones fueran realmente libres, su energía sólo dependería de la magnitud de su vector de onda k, no de su dirección. Es decir, en el k-espacio, el nivel de Fermi debería formar una esfera perfecta. La forma del nivel de Fermi puede medirse por resonancia de ciclotrón y nunca es una esfera, ni siquiera para el cesio.[8]
- ↑ La deficiencia de electrones es un término relativo: significa menos de la mitad de los electrones necesarios para completar la "siguiente" configuración de gas noble. Por ejemplo, el litio es deficiente en electrones con respecto al neón, pero rico en electrones con respecto al gas noble anterior, el helio.
- ↑ Élie Lévy, 1993. Diccionario Akal de física. Página 380.
- ↑ Shriver and Atkins' Inorganic Chemistry. Oxford University Press. 2010. pp. 74-. ISBN 978-0-19-923617-6.