Enol
Un enol es un alqueno que posee un grupo hidroxilo unido a uno de los átomos de carbonos del doble enlace. A este grupo funcional se lo denomina grupo enol; aunque es más común utilizar el término enol para referirse a los alquenoles, que el término alquenol mismo. Los enoles y los grupos carbonilo (como las cetonas y los aldehídos) son, de hecho, isómeros; esto es lo que se llama tautomería ceto-enol:
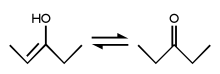
La forma enol es la mostrada en la izquierda. Usualmente es inestable, no sobrevive mucho, y cambia a la forma ceto (al isómero cetona), dibujada a la derecha. Esto se debe a que el oxígeno es más electronegativo que el carbono, y por eso tiene más fuerza su enlace. Un doble enlace carbono=oxígeno es más de dos veces más fuerte que un enlace carbono-oxígeno simple, pero un enlace carbono-carbono doble no es el doble de fuerte que dos enlaces simples carbono-carbono sino algo menos.
Solo en los compuestos 1,2-dicarbonilos y 1,3,5-tricarbonilos predomina la forma (mono)enol. En este caso es por una resonancia y por un puente hidrógeno intramolecular que tiene la forma enol, pero que no puede tener la forma ceto. Entonces, el propanodial (O=CH-CH2-CH=O) existe más de un 99% como un monoenol.
La palabra enol deriva de alqueno (o simplemente -eno, su sufijo) y alcohol (o el sufijo -ol).
Enoles enchusados editar
Cuando un enol pierde el Hα (el Hα es el H del Cα, y este es el que es vecino del C carbonilo), se forma el anión enolato como se muestra a continuación:
Los 1,3 dicarbonilos y 1,3,5 tricarbonilos son levemente ácidos, por la fuerte estabilidad de resonancia. Estos aniones enolato son muy preciados a la hora de sintetizar alcoholes y compuestos carbonilos muy complejos, como Enol (Adición aldólica). El valor sintético está dado gracias a que es nucleofílico, por tener una carga negativa neta.
Enol chus editar
Cuando el carbonilo de una aciloína con un hidrógeno α disponible presenta tautomería ceto-enol, se interconvierte a un enodiol. Este compuesto puede formar un segunda aciloína regioisomérica:
En química de carbohidratos, la tautomería de los carbonilos con un hidroxilo α se denomina transposición de Lobry de Bruyn–van Ekenstein, en donde la tautomería es catalizada por ácidos o bases y se interconvierte una aldosa a cetosa, formándose un enodiol como intermediario. Sucesivamente, las cetosas pueden ser transformadas a 3-cetosas, etcétera. El enodiol también es un intermediario para la epimerización de una aldosa o cetosa.[1][2]
Los enodioles son reductores, y al estar conjugados con un carbonilo se define el grupo funcional reductona. Estos compuestos son donadores de electrones eficientes y el ejemplo biológico clásico es el ácido ascórbico.
Referencias editar
- ↑ Momcilo Miljkovic Carbohydrates: Synthesis, Mechanisms, and Stereoelectronic Effects 2009 (Google books)
- ↑ ANGYAL, S.J.: The Lobry de Bruyn–Alberda van Ekenstein transformation and related reactions, in: Glycoscience: epimerisation, isomerisation and rearrangement reactions of carbohydrates, Vol. 215, (Ed.: STÜTZ, A.E.), Springer-Verlag, Berlin, 2001, 1–14