Meristemo apical del tallo
El meristema apical del tallo, situado en el apico de las plantas, es un tipo de meristema, ubicado en la zona de división y expansión celular dando origen a todos los tallos o ejes secundarios, hojas y flores. En el caso de los tallos con flores, los meristemas vegetativos se convierten en meristemas florales que dan origen a flores, no a hojas. Los primeros estadios de lo que serán los futuros órganos son conocidos como primordios (en singular: primordium). Cada primordium consiste en un grupo de células fundadoras que producen nuevas estructuras por medio de la división celular, ensanchamiento y la diferenciación de las mismas.
Usualmente, existe un tiempo de espera entre la iniciación de dos hojas sucesivas en un meristema apical de tallo, lo que resulta en un tallo compuesto de módulos repetidos. Cada módulo consiste en un internodo, un nodo y su hoja asociada y el meristema lateral del tallo, el cual se forma de la base de la hoja, y puede producir un tallo lateral cuando exista una influencia inhibitoria en el caso de que la punta principal del meristema del tallo sea removida, este proceso se da como resultado del transporte de Auxina desde el ápice del tallo, entre otros factores. Este comportamiento regulatorio, se encuentra dentro de las interacciones célula-célula, siendo los más determinantes en la definición del destino de las células de los meristemas.[1]
Histología editar
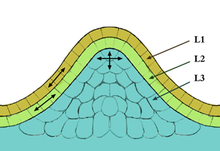
En la mayoría de las angiospermas, está compuesto por tres capas celulares situadas de forma estratificada:[2]
- La capa más externa, denominada L1, posee una capa celular de grosor. Sus células se dividen en un plano anticlinal.
- La capa intermedia, L2, está formada por células que se dividen en el plano anticlinal salvo en las zonas donde se originarán los órganos, donde se dividen de forma periclinal.
- La capa L3, la más interna, muestra planos de división al azar.
L1 siempre posee una sola capa celular, pero L2 y L3 son variables dependiendo del estado fisiológico de la planta y del genotipo. Este se encuentra en el ápice del tallo, en las yemas axilares, en la cofia de la raíz, etc.
Se define la túnica como el conjunto de células de las capas L1 y L2, mientras que se habla de corpus en referencia a la capa L3. La túnica genera la epidermis y el corpus los tejidos centrales del tallo y de las hojas.[2]
Desarrollo meristemático editar
El meristema apical de tallo tiene en general no más de 250μm de diámetro en las angiospermas y contiene un número reducido de células indiferenciadas que son las responsables de la división celular. La mayoría de las divisiones celulares en el desarrollo de una planta normal ocurren dentro de los meristemos o cerca de estos luego de que una célula ha dejado el meristemo, y gran parte del crecimiento de la planta se debe al alargamiento y ensanchamiento celular de estas.
Las células abandonan la periferia de los meristemas para formar órganos como las hojas y las flores, y son reemplazadas desde la zona central pequeña de división lenta hasta la punta del meristema. Este último proceso, es conocido como auto-regeneración de células madre.[3] En Arabidopsis esta zona comprende alrededor de 12 a 20 células. Estas células pueden dividirse y dar origen a una célula hija que se mantiene en su estado indiferenciado de célula madre y otra que pierde esta propiedad. Esta célula hija continua la división y sus descendientes son distribuidas por la parte periférica del meristema en donde se convierten en células fundadoras de nuevos órganos o internodos, abandonando el meristema y diferenciándose. las células madre del meristema son mantenidas en su estado auto-regenerativo e indiferenciado por células subyacentes de la zona central de este que crean un microambiente permitiendo que las células madre mantengan su identidad.[4]
Genes involucrados en el desarrollo del meristema del tallo editar
En Células madre y microambientes editar
Existen numerosos genes que controlan el comportamiento de las células en los meristemas, uno de ellos es el gen SHOOT MERISTEMLESS (STM)el cual está involucrado en la especificación del meristema del tallo durante el desarrollo del embrión en Arabidopsis, por ejemplo se expresa en los meristemas del tallo adultos pero suprimido tan pronto las células empiezan a formar parte del primordium de un órgano. Su rol parece que fuera mantener las células meristemáticas en un estado indiferenciado ya que la pérdida de la función de STM resulta en que todas las células del meristema se incorporen en el primordium de un órgano.[5] En contraste, existen otros genes que aumentan el tamaño de los meristemas como resultado de un aumento en el número de células madre en el centro de este; un ejemplo de éstos es CLAVATA (CLV) cuya mutación origina el proceso anteriormente descrito.[6]
Normalmente, a pesar de la continua salida de células de la fuente de las células madre, el número de células madre en el meristema se mantiene aproximadamente igual durante toda la vida de la planta, por la división de las células madre remanentes. El papel de los genes CLV en la regulación del número de células madre involucra una retroalimentación entre estas y el microambiente que las soporta.[7]
En Arabidopsis las células del microambiente expresan un factor de trasmisión homeobox, WUSCHEL (WUS). Este es requerido para la producción de una señal que le da a las células suprayacentes su identidad de célula madre. Mutaciones en WUS resultan en la terminación del meristema de tallo y en el cese del crecimiento como resultado de la pérdida de las células madre, mientras que la sobre-expresión aumenta el número de estas. las células madre expresan CLAVATA3 (CLV3), el cual codifica para una proteína secretada que actúa indirectamente en la producción de WUS. esta retroalimentación loop debería controlar la cantidad WUS en el microambiente y suprimir la activación de WUS en las células vecinas, así entonces se limitaría el grado de expresión de WUS. A su vez este regularía el tamaño de la zona disponible de células madre sobre el microambiente. Si la cantidad de células madre temporalmente decrece, por ejemplo, se produce menos CLV3 y WUS es expresado más ampliamente, como consecuencia del incremento de células madre, más CLV3 es producido limitando el grado de expresión de WUS. Otras proteínas CLAVATA están involucradas en la retroalimentación loop. (Ver figura 3.)Los meristemas pueden ser inducidos en cualquier lugar de la planta por la expresión errada de los genes involucrados en la especificación de la identidad de las células madre, indicando que la identidad de las células madre es conferida por interacciones célula - célula y no por un linaje celular especificado embrionariamente.[6][8]
En los patrones próximo-distal y adaxial-abaxial en el desarrollo de las hojas editar
Las hojas se desarrollan de grupos de células fundadoras dentro de la zona periférica del meristema apical del tallo. El primer indicio de la iniciación de una hoja en el meristema es usualmente un engrosamiento de la región en el lado del ápice, el cual forma el primordium de la hoja. Esta pequeña protuberancia es el resultado del incremento localizado de la multiplicación celular y los patrones alterados de la división celular. esto también refleja cambios en la expansión polarizada de las células.
Dos nuevos ejes que determinan el futuro de la hoja son establecidos en el primordium de la hoja. estos son el eje próximo-distal (de la base de la hoja a la punta de la hoja) y el eje adaxial-abaxial (de la parte superior a la parte inferior, en algunos casos llamado dorsal a ventral); este eje está relacionado con el eje radial del tallo. La superficie superior de la hoja se deriva de las células cercanas al centro de este eje (adaxial)mientras que la superficie inferior se deriva de las células ubicadas en la periferia del eje (abaxial). Estas dos superficies tienen diferentes funciones y estructuras, siendo la superficie superior la encargada de capturar la luz y realizar la fotosíntesis. Establecer la polaridad adaxial-abaxial es hacer uso de la información posicional a lo largo del eje radial del meristema. Diferentes genes son expresados en los que serán los lados adaxiales y abaxiales.[9] Por ejemplo: el gen FILAMENTOUS FLOWER (FIL) es normalmente expresado en lado abaxial del primordium de la hoja, y especifica el destino abaxial de las células. Esta expresión ectópica ocurrida en el primordium de la hoja, puede causar que todas las células adopten un destino celular abaxial, y que la hoja se desarrolle con una estructura cilíndrica.[10]
En la especificación del destino adaxial in Arabidopsisse involucran genes como PHABULOSA (PHAB), PHAVOLUTA (PHAV), y REVOLUTA (REV). Estos codifican para factores de transcripción y son inicialmente expresados en todo el primordium de la hoja pero restringidos a la superficie adaxial. Mutaciones en estos genes resultan en hojas simétricamente radiales con solo células de tipo abaxial características de la parte inferior de la hoja. Un micro ARN está involucrado en la restricción de la expresión de PHAB, PHAV y REV en el lado adaxial, orientando y destruyendo sus ARN mensajeros en el lado abaxial limitando su actividad a la superficie adaxial.[11][9] Se ha sugerido que, en plantas normales, la interacción entre las primeras células adaxiales y abaxiales, en el enlace entre ellas, se inicia el crecimiento lateral, resultando en la formación de la lámina foliar y los plegamientos de las hojas. Por otro lado, el desarrollo a lo largo del eje próximo-distal parece estar bajo control genético. Como en otros pastos, el primordium de la hoja del maíz, está compuesta por un prospecto de tejido proximal de vaina izquierda en el tallo y un prospecto de tejido de lámina izquierda distalmente. Las mutaciones en estos genes, terminan en que células distales toman identidades más proximales, por ejemplo: haciendo vaina en vez de hoja. La identidad posicional a lo largo del eje próximo-distal puede reflejar en algunos casos la edad de las células, las células distales adoptan un destino diferente al de las células proximales ya que ellas maduran más tarde.[9]
Otros factores importantes para el desarrollo del meristema editar
Es posible pensar que el desarrollo de los meristemas tiene algo de autonomía, porque si un meristema es aislado de tejidos adyacentes este continuará su desarrollo, aunque a una tasa mucho menor; así el desarrollo del meristema es dependiente de señales de otras partes de la planta. Meristemas apicales del tallo extirpados de una variedad de plantas puede crecer en un cultivo, donde se desarrollara en tallos completos con hojas si las hormonas de crecimiento auxina y citoquinina son añadidas. El comportamiento del meristema in situ, es influenciado por interacciones con el resto de la planta.
Como es sabido, el meristema apical genera una sucesión de nodos que en el caso del maíz, concluyen en una flor masculina, el número de nodos antes de esta flor está usualmente entre 16 y 22. Este número no es controlado por el meristema; ha sido reportado que meristemas aislados de plantas que ya han formado por lo menos 10 nodos, continúan su desarrollo de manera normal para completar en número total de nodos previos al desarrollo de la flor, sin embargo, los meristemas aislados no tienen memoria del número de nodos que ya han formado, repitiéndose el proceso desde el principio. Siendo así el meristema no está determinado en el embrión respecto al número de nodos que debería formar. De esta forma existe un control sobre el número de nodos que deben ser formados que involucra señales desde el resto de la planta hasta los meristemas, dirigiéndose a éstos para terminar en la formación del nodo.[9]
Referencias editar
- ↑ 1Wolpert, L., Jessell, T., Lawrence,P., Meyerowitz, E., Robertson, E. & Smith, J. (2007). Principles of development. (Tercera edición). Oxford University Press, Nueva York.
- ↑ a b Azcón-Bieto,J y Talón, M. (2000). Fundamentos de Fisiología Vegetal. Mc Graw Hill Interamericana de España SAU. ISBN 84-486-0258-7.
- ↑ Dodsworth,S. (2009). A diverse and intricate signalling network regulates stem cell fate in the shoot apical meristem. Developmental Biology, 336(1): 1-9
- ↑ Singh, M.B. & Bhalla, P. L. (2006). Plant stem cells carve their own niche. Trends in Plant Science, 11(5): 241-246
- ↑ Kaufmann, K., Pajoro, A. & Angenent, G.C. (2010). Regulation of transcription in plants: mechanisms controlling developmental switches. Nature Reviews Genetics, 11: 830–842.
- ↑ a b Brand, U., Fletcher, J.C, Hobe, M., Meyerowitz, E.M. & Simon, R.(2000). Dependence of Stem Cell Fate in Arabidopsis on a Feedback Loop Regulated by CLV3 Activity. Science, 289: 617-619.
- ↑ Brand, U., Fletcher, J.C, Hobe, M., Meyerowitz, E.M. & Simon, R.(2000). Dependence of Stem Cell Fate in Arabidopsis on a Feedback Loop Regulated by CLV3 Activity. Science, 289: 617-619.
- ↑ 1Wolpert, L., Jessell, T., Lawrence,P., Meyerowitz, E., Robertson, E. & Smith, J. (2007). Principles of development. (Tercera edición). Oxford University Press, Nueva York.
- ↑ a b c d 1Wolpert, L., Jessell, T., Lawrence,P., Meyerowitz, E., Robertson, E. & Smith, J. (2007).Principles of development. (Tercera edición). Oxford University Press, Nueva York.
- ↑ Chen, Q., Atkinson, A., Otsuga, D., Christensen, T., Reynolds, L., Drews, G.N. (1999). The Arabidopsis FILAMENTOUS FLOWER gene is required for flower formation. Development, 126(12):2715-2726.
- ↑ Kidner, C. (1998). Phabulosa and leafbladeless—new roles for the adaxial domain. Trends in Genetics, 14( 11): 445.