Autoanticuerpo
Un autoanticuerpo es un anticuerpo desarrollado por el sistema inmunitario que actúa directamente en contra de uno o más antígenos del propio individuo. Muchas enfermedades autoinmunes tienen su etiopatogenia en la sobreproducción de este tipo de anticuerpos, casos típicos son el lupus eritematoso sistémico y la artritis reumatoide. El nombre se deriva del griego "auto" que significa "propio", "anti" que quiere decir "contra" y "cuerpo".

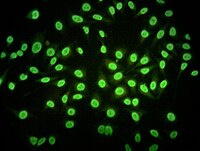
Producción
editarLos anticuerpos son normalmente producidos por el sistema inmunitario, en concreto por las células plasmáticas, en respuesta a antígenos (proteínas y sustancias extrañas para el organismo), que generalmente corresponde a organismos infecciosos. Normalmente, este sistema es capaz de reconocer e ignorar aquellos antígenos de las propias células del cuerpo, además de otras sustancias inofensivas, como aquellas provenientes de los alimentos, y de este modo no reaccionar en contra de ellas. Sin embargo, hay ocasiones en que el sistema inmunitario termina reaccionando contra uno o más antígenos propios, generando una superproducción de estos autoanticuerpos. Estos autoanticuerpos terminan por atacar las propias células, tejidos y órganos del cuerpo, causando inflamación y daño.
Causa y origen genético
editarLas causas que llevan a la producción de autoanticuerpos son variadas y todavía no son muy bien comprendidas. Al parecer la producción de algunos autoanticuerpos es debida a una cierta predisposición genética combinada con algún tipo de detonante ambiental, tal como por ejemplo una enfermedad viral, o la exposición prolongada a ciertos tipos de químicos tóxicos. De todas formas no existe una vinculación directa entre el componente genético y el desarrollo de una enfermedad. Ciertas familias destacan por presentar una mayor probabilidad de desarrollar determinadas condiciones autoinmunes, y dentro de sus miembros los desórdenes autoinmunes pueden ser totalmente diferentes, e incluso puede haber miembros que no desarrollen ningún tipo de trastorno. En cuanto a la predisposición por sexo, existen varias teorías diferentes, ya que las mujeres tienen una probabilidad mucho mayor que los hombres de desarrollar una enfermedad autoinmune, acentuándose esta probabilidad hacia los últimos años de la cuarta década de vida.[1] Una de las teorías más firmemente instaladas sostiene que puede existir una cierta componente hormonal en el desarrollo de este tipo de enfermedades, ya que los desórdenes autoinmunes son mucho más prevalentes entre las mujeres en edad fértil.[1] Otra de las teorías sostiene que puede existir una cierta asociación entre genes expresados en el cromosoma X y la predisposición a padecer este tipo de enfermedades, esta teoría explicaría porque las mujeres, que tienen dos copias del cromosoma X sufren mayor predisposición que los hombres que solo poseen una.[1]
Finalmente otra línea sostiene que las enfermedades autoinmunes están asociadas a una población particular de linfocitos B, llamados ABCs (por Age Associated B Cells: Linfocitos B asociados a la edad) Estos linfocitos expresan la cadena integral αX (CD11c), y normalmente su número aumenta en ratones hembras de mayor edad, pero también aparecen en los ratones "modelo" de lupus. Estos linfocitos B secretan anticuerpos al ser estimulados, y la reducción de estos linfocitos "in vivo" provoca una reducción de los anticuerpos autorreactivos. Un hecho que podría avalar esta teoría es que para el desarrollo de estos linfocitos es necesaria la señalización a través del Receptor de tipo Toll 7. El gen que codifica a este receptor se encuentra en el cromosoma X.[2]
Tipos
editarFactor reumatoide
editarLos factores reumatoides (FR) son autoanticuerpos dirigidos contra el fragmento Fc de las inmunoglobulinas G. Estos autoanticuerpos pueden ser de clase IgG, IgM, IgA o IgE. La técnica más usada en clínica para su determinación es la Aglutinación del Látex. En ella, se recubren partículas de látex con anticuerpos IgG humanos. En un paso posterior se agrega la muestra del paciente en estudio. Si este suero contiene anticuerpos que reconocen los fragmentos Fc, habrá aglutinación de las partículas de látex, lo que es visible a ojo desnudo o puede ser cuantificado por turbidimetría.
La técnica de látex detecta fundamentalmente FR de clase IgM, ya que es una inmunoglobulina pentavalente y eficiente como aglutinante. Se informa en títulos o en UI/ml. Son significativos títulos mayores de 1:80 o mayores de 50 UI/ml. Otras técnicas que pueden ser utilizadas para pesquisar FR son la nefelometría y los enzimoinmunoensayos (ELISA). Cada técnica varía en la forma de expresión de resultados, por lo que el clínico debe informarse con el laboratorio de cuál ha sido la técnica utilizada y lo que es considerado como positivo.
El FR se asocia principalmente a artritis reumatoide (AR) y a síndrome de Sjögren (SS). 75%-90% de las AR tienen un FR positivo para IgM en títulos significativos > 1:80 (AR seropositivas). Los pacientes con AR y títulos elevados de FR, tienden a tener una enfermedad agresiva y con mayor compromiso extraarticular.
Los FR no son específicos de AR. Pueden encontrarse en otras enfermedades: tuberculosis, endocarditis bacteriana, sarcoidosis, lepra, fibrosis pulmonar, enfermedades hepáticas y sífilis. También pueden encontrarse en otras afecciones reumatológicas inflamatorias con títulos más bajos que en la AR. Los FR, al igual que otros autoanticuerpos, pueden encontrarse en población sana (1%-5%) en títulos bajos, como en personas mayores de 60 años, donde la frecuencia alcanza hasta el 20%. Por lo que la presencia de un FR positivo debe ser interpretada en el contexto de cada paciente individual.
Anticuerpos anti péptidos cíclicos citrulinados (ACCP)
editarMuchas proteínas con función estructural, tales como la filagrina, queratina y las histonas, siguen una vía común de modificaciones postraduccionales en las que participa una enzima llamada peptidil arginina deaminasa; esta enzima actúa sobre los residuos de arginina de las proteínas eliminando el grupo amino terminal. La modificación postraduccional convierte los residuos de arginina en citrulina, lo que causa la pérdida de la carga positiva del aminoácido y como consecuencia importantes modificaciones en las interacciones del residuo con sus vecinos. Esta modificación tiene importantes consecuencias estructurales, favoreciendo la formación de filamentos. En el año 1998 Schellkens describe la existencia de anticuerpos anti péptidos citrulinados en pacientes con artritis reumatoidea y un año después Van Jaarsveld demuestra la especificidad para esta enfermedad.[3][4]
La primera generación de inmunoensayos para detectar estos anticuerpos hacía uso de variantes lineales de filagrina, pero ya en la segunda generación de inmunoensayos se comenzó a utilizar péptidos citrulinados sintéticos ciclados. La ciclación de los péptidos favorece la exposición de determinantes antigénicos que presentan el aminoácido citrulina, lo que aumenta la sensibilidad y la especificidad de los ensayos.
Son de más reciente uso en clínica. Están presentes en artritis erosiva en forma muy precoz. Son útiles en el diagnóstico temprano de la Artritis Reumatoide, que cursa con FR negativo.[4]
Anticuerpos antifosfolípidos (AFL)
editarEstos anticuerpos se encuentran en el síndrome antifosfolípidos (SAFL), que es una entidad autoinmune que se puede dar aislada (SAFL Primario) o asociada a alguna otra entidad, más frecuentemente el LES (SAFL Secundario).
En lo clínico este síndrome se caracteriza por trombosis recurrentes y pérdida habitual de embarazos tempranos o tardíos (muerte fetal).
Los AFL de mayor uso en clínica a la fecha y que sirven como screening de esta entidad son los anticuerpos anticardiolipinas y el anticoagulante lúpico. Para identificar serológicamente al SAFL, se deben solicitar ambos anticuerpos los ACL y anticoagulante lúpico, ya que no siempre se dan juntos. Numerosos trastornos, como la inflamación o infección pueden causar AFL en forma transitoria. Por el contrario, la persistencia de la positividad de AFL en al menos dos mediciones separadas por un mínimo de seis semanas es lo que caracteriza al SAFL.
Anticuerpos Anticardiolipinas (ACL)
editarSe detectan por ELISA, lo que permite identificar la clase de anticuerpo y su título. Lo más asociado al SAFL son los ACL clase IgG, y a títulos moderados o elevados. Se informan en unidades GPL o MPL o APL según sea la clase de inmunoglobulina identificada (IgG, IgM o IgA, respectivamente).
Anticoagulante Lúpico (AL)
editarSe detecta por técnicas de coagulación. No sirve para conocer el título de anticuerpo o el nivel de positividad.
Anticuerpos antimitocondriales (AMA)
editarSe trata de un grupo de anticuerpos dirigidos contra proteínas presentes en la membrana interna y externa de las mitocondrias. Se han identificado 9 subtipos de AMA nombrados de M1 a M9 con diferente significancia clínica. El subtipo más frecuentemente encontrado es el M2, un anticuerpo que se encuentra dirigido específicamente contra la subunidad E2 del complejo enzimático piruvato deshidrogenasa. Este subtipo se encuentra clínicamente relacionado con la cirrosis biliar primaria (CBP) una patología que afecta predominantemente a los conductos biliares del hígado, causando obstrucciones y finalmente destrucción del parénquima hepático. Los AMA M2 se encuentran presentes en el 95% de los pacientes que cumplen con otros criterios diagnósticos de CBP,[5] por lo que resultan una herramienta de enorme valor diagnóstico en ausencia de otros indicadores. Se ha demostrado que la presencia de AMA es patológica (indican enfermedad), pero no patogénica (no son los causantes de la misma). Títulos mayores a 1/80 poseen un 97% de especificidad y 98 % de sensibilidad. El 10 % de los enfermos con cirrosis biliar primaria presentan títulos menores de 1/16. Aparecen generalmente en mujeres entre la cuarta y la sexta década de vida.
Anticuerpos anticitoplasma de neutrófilos (ANCA)
editarEstos anticuerpos son útiles para determinar vasculitis. Se detectan por IFI, usando como sustrato polimorfonucleares (PMN). Si el sustrato de PMN se fija con etanol, se pueden identificar dos tipos de tinción. La fluorescencia citoplasmática (C-ANCA) y la perinuclear (P-ANCA). Los anticuerpos que dan C-ANCA están dirigidos mayoritariamente contra la proteinasa 3 (PR3), y son altamente específicos de Granulomatosis de Wegener. Los anticuerpos que dan un P-ANCA pueden estar dirigidos contra la mieloperoxidasa (MPO), elastasa, catepsina y otros antígenos. Los que reconocen MPO se asocian a vasculitis sistémica con compromiso renal rápidamente progresivo. La especificidad de los ANCA debe ser confirmada por enzimoinmunoensayo (ELISA).
Anticuerpos antinucleares (ANA)
editarLa primera evidencia de anticuerpos antinucleares surge con la descripción de la “Célula del Lupus”, o célula LE, hecha por Hargraves en 1948. Corresponde a un polimorfonuclear (PMN), que ha fagocitado material nuclear de una segunda célula que ha sido reconocida por autoanticuerpos. Este fenómeno, que puede ser reproducido in vitro, es un test poco sensible y poco específico para lupus eritematoso sistémico (LES); por lo tanto, de poca utilidad como técnica de screening. Sin embargo, su aparición in vivo en muestras de líquidos pleurales o en líquido peritoneal orientan a un LES. Es una técnica algo engorrosa para la detección de anticuerpos, por lo que ha sido desplazada en la actualidad. Los ANA se detectan más frecuentemente, por Inmunofluorescencia indirecta (IFI), usando como sustrato cortes de tejido de roedores (hígado riñón y estómago) o líneas de células neoplásicas en cultivo, como las HEp-2, que son el sustrato preferido. De existir ANA, éstos son reconocidos con el uso de un microscopio de fluorescencia.
La fluorescencia puede mostrar distintos patrones de tinción nuclear, y muchas otras veces muestra tinción citoplasmática. Esto se debe a que distintas estructuras antigénicas son reconocidas.
Existen cinco patrones clásicos de tinción nuclear: homogéneo, granular o moteado, nucleolar, periférico y anticentrómero. El patrón homogéneo y el periférico son los más frecuentes de observar en LES, pero son inespecíficos. El patrón moteado o granular se observa frecuentemente en Síndrome de Sjögren y LES, y, a la vez, se asocian con anticuerpos a-ENA. El patrón nucleolar se observa principalmente en la esclerosis sistémica progresiva (ESP). El único patrón que es altamente específico es el anticentrómero, que es marcador de una variedad de ESP, denominada CREST.
Los ANA se pueden observar prácticamente en todas las enfermedades del tejido conectivo (ETC), es decir, tienen alta sensibilidad para este grupo de enfermedades reumatológicas, pero a su vez carecen de especificidad. En las ETC los ANA tienen por lo general títulos elevados (mayores a 1:160), sobre todo en enfermedad activa. Al igual que otros autoanticuerpos, los ANA se pueden observar en sujetos jóvenes, y son más frecuentes en personas mayores de 60 años. También pueden estar presentes en otras enfermedades (hepáticas, pulmonares, infecciones crónicas, neoplasias, drogadicción); en estos casos, sus títulos tienden a ser más bajos.
En resumen, los ANA son un buen test de screening de autoanticuerpos en ETC. Sin embargo requiere posteriores investigaciones para determinar cuál es el antígeno blanco reconocido por estos ANA (DNA, histonas o proteínas no histonas o asociadas a RNA).
Anti-ADN
editarLos anticuerpos anti-ADN pueden estar dirigidos contra el ADN de una hebra (monocatenario o desnaturalizado) o contra el de doble hebra o “nativo”. Los a-ADN nativos son bastante específicos para LES (95%), por lo tanto, útiles en el diagnóstico de esta entidad. Estos pueden fluctuar con la actividad de la enfermedad. Se asocian a compromiso renal lúpico. Los a-ADN nativo se pueden detectar por IFI usando como sustrato Crithidia luciliae (un parásito hemoflagelado). También se pueden detectar por técnica de Farr (basada en la precipitación de complejos inmunes que contienen ADN) y por ELISA.
Los a-ADN monocatenarios no se usan de rutina en la práctica clínica. Ya que pueden encontrarse en muchas enfermedades reumatológicas y carecen de especificidad.
Anti-ENA
editarLos anticuerpos dirigidos contra antígenos nucleares extractables reciben el nombre de a-ENA. Estos antígenos nucleares son por lo general proteínas no histonas o complejos ARN-proteínas. Se pueden detectar por doble difusión en agar, ELISA o inmunoblot. Lo más frecuente es el ELISA.
Los anti-ENA de mayor uso en clínica son:
- Anti-Ro/SS-A: se encuentran en LES y Síndrome de Sjögren, en el Lupus cutáneo subagudo y en el Lupus neonatal.
- Anti-La/SS-B: también observados en LES y Síndrome de Sjögren
- Anti-Sm: poco frecuentes, pero altamente específicos de LES.
- Anti-RNP: se pueden observar en LES y otras ETC. Cuando se detectan como único anticuerpo, caracteriza a la enfermedad mixta del tejido conectivo (EMTC).
- Anti-Scl-70 o anti topoisomerasa 1: frecuentes en la Esclerodermia.
- Anti-Jo-1 o anti-Histidil ARNt transferasa. Se encuentra en polimiositis, dermatomiositis o enfermedades de sobreposición. Clínicamente caracteriza a un grupo de pacientes con miositis, Raynaud y compromiso pulmonar con fibrosis intersticial.
Lista de algunos autoanticuerpos y enfermedades más comúnmente asociadas
editarMuchos autoanticuerpos han sido reconocidos y tienen interés médico en algunas enfermedades, dentro de los más destacables se encuentran:
Nota: la sensibilidad y especificidad de uno o varios anticuerpos varía dentro de una misma enfermedad y es diferente para diferentes enfermedades.
El tipo de enfermedad autoinmune que ocurre depende de la magnitud del daño hecho por los anticuerpos y en qué órganos se encuentran los antígenos para estos. En general, aquellos desórdenes autoinmunes órgano-específicos (como la tiroiditis de Hashimoto ) resultan de más fácil diagnóstico en comparación con aquellas enfermedades que actúan a nivel antigénico de todo el organismo (como el LES).
Bibliografía
editar- Mitchell, Richard Sheppard; Kumar, Vinay; Abbas, Abul K.; Fausto, Nelson Robbins Basic Pathology 8th edition Saunders 2007.
- Tietz N. W. Clinical Guide to Laboratory test. Saunders 1995.
Referencias
editar- ↑ a b c Oliver, Jacqueline E.; Silman, Alan J. (2009). «Why are women predisposed to autoimmune rheumatic diseases?». Arthritis Research & Therapy 11 (5): 1305-1315. doi:10.1186/ar2825. Archivado desde el original el 28 de septiembre de 2015. Consultado el 25 de marzo de 2012.
- ↑ Rubtsov, Anatoly V.; Rubtsova, Kira; Fischer, Aryeh; Meehan, Richard T.; Gillis, Joann Z.; Kappler, John W.; Marrack, Philippa (2011). «Toll-like receptor 7 (TLR7)–driven accumulation of a novel CD11c+ B-cell population is important for the development of autoimmunity». Blood 118 (5): 1305-1315. doi:10.1182/blood-2011-01-331462. Consultado el 25 de marzo de 2012.
- ↑ Schellekens GA, de Jong BA, van den Hoogen FH, van de Putte LB and van Venrooij WJ (1998). «Citrulline is an essential constituent of antigenic determinants recognized by rheumatoid arthritis-specific autoantibodies.». J Clin Invest 17: 273-81. doi:10.1172/JCI1316.
- ↑ a b van Jaarsveld CH, ter Borg EJ, Jacobs JW, Schellekens GA, Gmelig-Meyling FH, van Booma-Frankfort C, de Jong BA, van Venrooij WJ, Bijlsma JW. (1999). «The prognostic value of the antiperinuclear factor, anti-citrullinated peptide antibodies and rheumatoid factor in early rheumatoid arthritis.». Clin Exp Rheumatol. 17 (6): 689-97. PMID 10609067.
- ↑ a b Oertelt S, Rieger R, Selmi C, Invernizzi P, Ansari A, Coppel R, Podda M, Leung P, Gershwin M (2007). «A sensitive bead assay for antimitochondrial antibodies: Chipping away at AMA-negative primary biliary cirrhosis». Hepatology 45 (3): 659-65. PMID 17326160. doi:10.1002/hep.21583.
- ↑ Table 5-9 in: Mitchell, Richard Sheppard; Kumar, Vinay; Abbas, Abul K.; Fausto, Nelson (2007). Robbins Basic Pathology. Philadelphia: Saunders. ISBN 1-4160-2973-7. 8th edition.
- ↑ a b Wesierska-Gadek J, Hohenuer H, Hitchman E, Penner E (1996). «Autoantibodies against nucleoporin p62 constitute a novel marker of primary biliary cirrhosis». Gastroenterology 110 (3): 840-7. PMID 8608894. doi:10.1053/gast.1996.v110.pm8608894.
- ↑ Szostecki C, Guldner HH, Netter HJ, Will H (1990). «Isolation and characterization of cDNA encoding a human nuclear antigen predominantly recognized by autoantibodies from patients with primary biliary cirrhosis». J. Immunol. 145 (12): 4338-47. PMID 2258622.
- ↑ Itoh S, Ichida T, Yoshida T, et al. (1998). «Autoantibodies against a 210 kDa glycoprotein of the nuclear pore complex as a prognostic marker in patients with primary biliary cirrhosis». J. Gastroenterol. Hepatol. 13 (3): 257-65. PMID 9570238. doi:10.1111/j.1440-1746.1998.01553.x.
- ↑ Pedreira S, Sugai E, Moreno ML, et al. (2005). «Significance of smooth muscle/anti-actin autoantibodies in celiac disease». Acta Gastroenterol. Latinoam. 35 (2): 83-93. PMID 16127984.
- ↑ Carroccio A, Brusca I, Iacono G, et al. (2007). «IgA anti-actin antibodies ELISA in coeliac disease: A multicentre study». Digestive and Liver Disease 39 (9): 814. PMID 17652043. doi:10.1016/j.dld.2007.06.004.
- ↑ Kerkar N, Ma Y, Davies ET, Cheeseman P, Mieli-Vergani G, Vergani D (diciembre de 2002). «Detection of liver kidney microsomal type 1 antibody using molecularly based immunoassays». J. Clin. Pathol. 55 (12): 906-9. PMC 1769836. PMID 12461054. doi:10.1136/jcp.55.12.906.
Véase también
editar