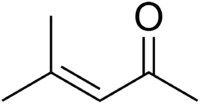
Isopropiliden acetona
compuesto químico
La isopropiliden acetona u óxido de mesitilo es una cetona α, β-insaturada con la fórmula CH3C (O)CH = C(CH3)2. Este compuesto es un líquido volátil e incoloro con un olor a miel.[3]
| Isopropiliden acetona | ||||||
|---|---|---|---|---|---|---|
| ||||||
| Nombre IUPAC | ||||||
| 4-metilpent-3-en-2-ona | ||||||
| General | ||||||
| Otros nombres |
Óxido de mesitilo Isobutenil metil cetona Metil isobutenil cetona | |||||
| Fórmula semidesarrollada | C6H10O | |||||
| Fórmula molecular | ? | |||||
| Identificadores | ||||||
| Número CAS | 141-79-7[1] | |||||
| Número RTECS | SB4200000 | |||||
| ChEBI | 89993 | |||||
| ChEMBL | CHEMBL3185916 | |||||
| ChemSpider | 8526 | |||||
| PubChem | 8858 | |||||
| UNII | 77LAC84669 | |||||
|
O=C(\C=C(/C)C)C
| ||||||
| Propiedades físicas | ||||||
| Apariencia | Líquido aceitoso, incoloro a amarillo pálido[2] | |||||
| Olor | Mentolado- como a miel[2] | |||||
| Densidad | 858 kg/m³; 0,858 g/cm³ | |||||
| Masa molar | 98,145 g/mol | |||||
| Punto de fusión | −53 °C (220 K) | |||||
| Punto de ebullición | 129,5 °C (403 K) | |||||
| Presión de vapor | 9 mmHg (20°C)[2] | |||||
| Propiedades químicas | ||||||
| Solubilidad en agua | 3% (20°C)[2] | |||||
| Solubilidad | Soluble en la mayoría de los compuestos orgánicos | |||||
| Peligrosidad | ||||||
| Temperatura de autoignición | 304 K (31 °C) | |||||
| Frases R | R10 R20/21/22 | |||||
| Frases S | S25 | |||||
| Límites de explosividad | 1.4%-7.2%[2] | |||||
| Riesgos | ||||||
| Riesgos principales | Riesgo a la salud | |||||
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||||||
Síntesis
editarLa isopropiliden acetona se prepara mediante la condensación aldólica de la acetona para dar el alcohol de diacetona, el cual se deshidrata fácilmente para dar este compuesto..[4]
La forona y la isoforona se pueden ser formar bajo las mismas condiciones. La isoforona se origina vía adición de Michael :
La forona se forma por una segunda condensación aldólica:
Usos
editarEsta cetona se utiliza como disolvente y como precursor de la síntesis del metil isobutil cetona por hidrogenación:
La hidrogenación completa produce 4-metil-2-pentanol.
Referencias
editar- ↑ Número CAS
- ↑ a b c d e NIOSH Pocket Guide to Chemical Hazards. "#0385". National Institute for Occupational Safety and Health (NIOSH).
- ↑ Merck Índice, 14.ª Edición
- ↑ J. B. Conant and Neal Tuttle (1921). Mesityl Oxide 1. p. 53. doi:10.15227/orgsyn.001.0053.