Transposición de Claisen
La transposición de Claisen (que no debe confundirse con la condensación de Claisen) es una reacción química orgánica pericíclica, que forma enlaces carbono-carbono. Fue descubierta por Rainer Ludwig Claisen. El calentamiento de un alil vinil éter iniciará una reordenación sigmatropica [3,3] para dar un carbonilo γ, δ-insaturado.
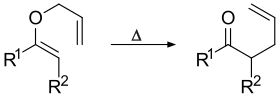
Fue descubierto en 1912, el reordenamiento de Claisen es el primer ejemplo registrado de una transposición sigmatrópica [3,3].[1][2][3][4][5][6][7]
Mecanismo editar
La transposición de Claisen es una reacción pericíclica exotérmica concertada. Las reglas de Woodward-Hoffmann muestran una ruta de reacción suprafacial, estereoespecífica. La cinética es de primer orden y toda la transformación procede a través de un estado de transición cíclico intramolecular altamente ordenado. Los experimentos cruzados eliminan la posibilidad de que la transposición ocurra a través de un mecanismo de reacción intermolecular y son consistentes con un proceso intramolecular.[8][9]
Se observan efectos sustanciales del disolvente en la transposición de Claisen, donde los disolventes polares tienden a acelerar la reacción en mayor medida. Los disolventes de enlace de hidrógeno dieron las constantes de velocidad más altas. Por ejemplo, las mezclas de solventes de etanol / agua dan constantes de velocidad 10 veces más altas que el sulfolano. Se ha demostrado que los reactivos de organoaluminio trivalentes, como el trimetilaluminio, aceleran esta reacción.[10][11][12][13]
Variaciones editar
Transposición de Claisen Aromática editar
Reportada en alil aril éteres. La transposición de Claisen reportada es la transposición sigmatropica [3,3] , que rápidamente se tautomeriza a un fenol orto-sustituido.
La meta-sustitución afecta la regioselectividad de este reordenamiento. Por ejemplo, los grupos de extracción de electrones (como el bromuro) en la posición meta dirigen el reordenamiento a la posición orto (71% de producto orto), mientras que los grupos donadores de electrones (como el metoxi), reorganización directa a la posición para (69) % para producto). Además, la presencia de sustituyentes orto conduce exclusivamente a productos de reordenamiento para-sustituidos (reordenamiento en tándem de Claisen y Cope).[14][15][16]
Si un aldehído o ácido carboxílico ocupa las posiciones orto o para, la cadena lateral alilo desplaza al grupo, liberándolo como monóxido de carbono o dióxido de carbono, respectivamente.[17][18]
Transposición de Bellus–Claisen editar
La transposición de Bellus-Claisen es la reacción de éteres alílicos, aminas y tioéteres con cetenas para formar ésteres, amidas y tioésteres γ, δ-insaturados. Esta transformación fue observada por casualidad por Bellus en 1979 a través de su síntesis de un intermediario clave de un insecticida piretroide. Las cetenas sustituidas con halógeno (R1, R2) se usan a menudo en esta reacción por su alta electrofilicidad. Se han desarrollado numerosos métodos reductores para la eliminación de los α-haloésteres, amidas y tioésteres resultantes. Es muy útil como estrategia de expansión de anillos.[19][20][21][22][23]
Transposición de Eschenmoser–Claisen editar
La transposición de Eschenmoser-Claisen se lleva a cabo calentando alcoholes alílicos en presencia de N, N-dimetilacetamida dimetil acetal para formar una amida γ, δ-insaturada. Esto fue desarrollado por Albert Eschenmoser en 1964. La principal aplicación de la trnasposición de Eschenmoser-Claisen se usó como un paso clave en la síntesis total de la morfina.[24][25][26]
Mecanismo[16]
Transposición de Ireland–Claisen editar
La transposición de Ireland-Claisen es la reacción de un carboxilato alílico (éster tipo acrilato) con una base fuerte (como la diisopropilamida de litio) para dar un ácido carboxílico γ, δ-insaturado. La transposición se realiza a través del acetal de sililceteno, que se forma atrapando el enolato de litio con clorotrimetilsilano. Al igual que el método de Bellus-Claisen (arriba), la transposición de Ireland-Claisen puede tener lugar a temperatura ambiente y superior. Los acetales de sililcetena configurados con E y Z conducen a productos transpuestos anti y syn, respectivamente. Existen numerosos ejemplos de transposiciones enantioselectivas de Ireland-Claisen que se encuentran en la literatura para incluir reactivos de boro quirales y el uso de auxiliares quirales.[27][28][29][30]
Transposición de Johnson–Claisen editar
La transposición de Johnson–Claisen es la reacción de un alcohol alílico con un ortoéster para producir un éster γ, δ-insaturado. Los ácidos débiles, como el ácido propiónico, se han utilizado para catalizar esta reacción. Esta transposición a menudo requiere altas temperaturas (100–200 °C) y puede tardar entre 10 y 120 horas en completarse. Sin embargo, el calentamiento asistido por microondas en presencia de arcilla KSF o ácido propiónico ha demostrado incrementos dramáticos en la velocidad de reacción y los rendimientos.[31][32][33]
Mecanismo:[16]
La transposición de Claisen de aril éteres también se puede realizar como una reacción fotoquímica. Además del producto orto tradicional obtenido en condiciones térmicas (el producto de reordenamiento [3,3]), la variación fotoquímica también da al producto para (producto [3,5]), isómeros alternativos del grupo alilo (por ejemplo, [ 1,3] y [1,5] productos), y la pérdida simple del grupo éter, e incluso pueden reorganizar alquil éteres además de alil éteres. La reacción fotoquímica se produce a través de un proceso gradual de escisión de radicales seguido de formación de enlaces en lugar de una reacción pericíclica concertada, lo que permite la mayor variedad de posibles sustratos e isómeros del producto. Los resultados [1,3] y [1,5] del reordenamiento foto-Claisen son análogos al reordenamiento foto-Fries de los ésteres de arilo y compuestos de acilo relacionados.[34][35]
Modificaciones heteroatómicas editar
Transposición Aza–Claisen editar
Un catión iminio puede servir como uno de los residuos con enlace π en la transposición.[36]
Oxidación crómica editar
El cromo puede oxidar los alcoholes alílicos a cetonas α, β-insaturadas en el lado opuesto del enlace insaturado del alcohol. Esto es a través de una reacción hetero-Claisen concertada, aunque existen diferencias mecanicistas ya que el átomo de cromo tiene acceso a d-orbitales que permiten la reacción bajo un conjunto de geometrías menos restringidas.[37][38]
Transposición de Chen–Mapp editar
La reacción de Chen-Mapp, también conocida como la transposición [3,3] -fosforimidato o reacción de Staudinger-Claisen, inserta un fosfito en lugar de un alcohol y aprovecha la reducción de Staudinger para convertirlo en una imina. La transposición de Claisen posterior es impulsada por el hecho de que un doble enlace P = O es más energéticamente favorable que un doble enlace P = N.[39]
Transposición de Overman editar
La transposición de Overman (llamada así por Larry Overman) es una transposición de Claisen de tricloroacetimidatos alílicos a tricloroacetamidas alílicas.[40][41][42]
La transposición de Overman es aplicable a la síntesis de compuestos de diamino de vicinol a partir de dioles alílicos 1,2-vicinales.
Transposición de Claisen zwitteriónica editar
A diferencia de los reordenamientos de Claisen típicos que requieren calentamiento, los reordenamientos de Claisen zwitteriónicos tienen lugar a temperatura ambiente o por debajo de ella. Los iones de acilamonio son altamente selectivos para los enolatos Z en condiciones leves.[43][44]
Transposición de Claisen biológica editar
La enzima corismato mutasa (EC 5.4.99.5) cataliza la reorganización de Claisen del corismato a prefenato, un intermediario clave en la ruta biosintética hacia la síntesis de fenilalanina y tirosina.[45]
Vésase también editar
- Transposición de Carroll rearrangement
- Transposición de Cope
Referencias editar
- ↑ Claisen, L. (1912). «Über Umlagerung von Phenol-allyläthern in C-Allyl-phenole». Chemische Berichte 45 (3): 3157-3166. doi:10.1002/cber.19120450348.
- ↑ Claisen, L.; Tietze, E. (1925). «Über den Mechanismus der Umlagerung der Phenol-allyläther». Chemische Berichte 58 (2): 275. doi:10.1002/cber.19250580207.
- ↑ Claisen, L.; Tietze, E. (1926). «Über den Mechanismus der Umlagerung der Phenol-allyläther. (2. Mitteilung)». Chemische Berichte 59 (9): 2344. doi:10.1002/cber.19260590927.
- ↑ Hiersemann, M.; Nubbemeyer, U. (2007) The Claisen Rearrangement. Wiley-VCH. ISBN 3-527-30825-3
- ↑ Rhoads, S. J.; Raulins, N. R. (1975). The Claisen and Cope Rearrangements 22. pp. 1-252. ISBN 978-0471264187. doi:10.1002/0471264180.or022.01.
- ↑ Ziegler, F. E. (1988). «The thermal, aliphatic Claisen rearrangement». Chem. Rev. 88 (8): 1423-1452. doi:10.1021/cr00090a001.
- ↑ Wipf, P. (1991). Claisen Rearrangements 5. pp. 827-873. ISBN 978-0-08-052349-1. doi:10.1016/B978-0-08-052349-1.00140-2.
- ↑ Hurd, C. D.; Schmerling, L. (1937). «Observations on the Rearrangement of Allyl Aryl Ethers». J. Am. Chem. Soc. 59: 107. doi:10.1021/ja01280a024.
- ↑ Francis A. Carey; Richard J. Sundberg (2007). Advanced Organic Chemistry: Part A: Structure and Mechanisms. Springer. pp. 934-935. ISBN 978-0-387-44897-8.
- ↑ Claisen, L. (1912). «Über Umlagerung von Phenol-allyläthern in C-Allyl-phenole». Chemische Berichte 45 (3): 3157-3166. doi:10.1002/cber.19120450348.
- ↑ Claisen, L.; Tietze, E. (1925). «Über den Mechanismus der Umlagerung der Phenol-allyläther». Chemische Berichte 58 (2): 275. doi:10.1002/cber.19250580207.
- ↑ Goering, H. L.; Jacobson, R. R. (1958). «A Kinetic Study of the ortho-Claisen Rearrangement1». J. Am. Chem. Soc. 80 (13): 3277. doi:10.1021/ja01546a024.
- ↑ White, W. N.; Wolfarth, E. F. (1970). «The o-Claisen rearrangement. VIII. Solvent effects». J. Org. Chem. 35 (7): 2196. doi:10.1021/jo00832a019.
- ↑ White, William; and Slater, Carl, William N.; Slater, Carl D. (1961). «The ortho-Claisen Rearrangement. V. The Products of Rearrangement of Allyl m-X-Phenyl Ethers». The Journal of Organic Chemistry 26 (10): 3631-3638. doi:10.1021/jo01068a004.
- ↑ Gozzo, Fábio; Fernandes, Sergio; Rodrigues, Denise; Eberlin, Marcos; and Marsaioli, Anita, Fábio Cesar; Fernandes, Sergio Antonio; Rodrigues, Denise Cristina; Eberlin, Marcos Nogueira; Marsaioli, Anita Jocelyne (2003). «Regioselectivity in Aromatic Claisen Rearrangements». The Journal of Organic Chemistry 68 (14): 5493-5499. PMID 12839439. doi:10.1021/jo026385g.
- ↑ a b c László Kürti; Barbara Czakó (2005). Strategic Applications Of Named Reactions In Organic Synthesis: Background And Detailed Mechanics: 250 Named Reactions. Academic Press. ISBN 978-0-12-429785-2. Consultado el 27 de marzo de 2013.
- ↑ Adams, Rodger (1944). Organic Reactions, Volume II. Newyork: John Wiley & Sons, Inc. pp. 11-12.
- ↑ Claisen, L.; Eisleb, O. (1913). «Über die Umlagerung von Phenolallyläthern in die isomeren Allylphenole». Justus Liebigs Annalen der Chemie 401 (1): 90. doi:10.1002/jlac.19134010103.
- ↑ Malherbe, R.; Bellus, D. (1978). «A New Type of Claisen Rearrangement Involving 1,3-Dipolar Intermediates. Preliminary communication». Helv. Chim. Acta 61 (8): 3096-3099. doi:10.1002/hlca.19780610836.
- ↑ Malherbe, R.; Rist, G.; Bellus, D. (1983). «Reactions of haloketenes with allyl ethers and thioethers: A new type of Claisen rearrangement». J. Org. Chem. 48 (6): 860-869. doi:10.1021/jo00154a023.
- ↑ Gonda, J. (2004). «The Belluš–Claisen Rearrangement». Angew. Chem. Int. Ed. 43 (27): 3516-3524. PMID 15293240. doi:10.1002/anie.200301718.
- ↑ Edstrom, E (1991). «An unexpected reversal in the stereochemistry of transannular cyclizations. A stereoselective synthesis of (±)-epilupinine». Tetrahedron Letters 32 (41): 5709-5712. doi:10.1016/S0040-4039(00)93536-6.
- ↑ Bellus (1983). «Reactions of haloketenes with allyl ethers and thioethers: a new type of Claisen rearrangement». The Journal of Organic Chemistry 48 (6): 860-869. doi:10.1021/jo00154a023.
- ↑ Wick, A. E.; Felix, D.; Steen, K.; Eschenmoser, A. (1964). «CLAISEN'sche Umlagerungen bei Allyl- und Benzylalkoholen mit Hilfe von Acetalen des N, N-Dimethylacetamids. Vorläufige Mitteilung». Helv. Chim. Acta 47 (8): 2425-2429. doi:10.1002/hlca.19640470835.
- ↑ Wick, A. E.; Felix, D.; Gschwend-Steen, K.; Eschenmoser, A. (1969). «CLAISEN'sche Umlagerungen bei Allyl- und Benzylalkoholen mit 1-Dimethylamino-1-methoxy-äthen». Helv. Chim. Acta 52 (4): 1030-1042. doi:10.1002/hlca.19690520418.
- ↑ Guillou, C (2008). «Diastereoselective Total Synthesis of (±)-Codeine». Chem. Eur. J. 14 (22): 6606-6608. PMID 18561354. doi:10.1002/chem.200800744.
- ↑ Ireland, R. E.; Mueller, R. H. (1972). «Claisen rearrangement of allyl esters». Journal of the American Chemical Society 94 (16): 5897. doi:10.1021/ja00771a062.
- ↑ Ireland, R. E.; Willard, A. K. (1975). «The stereoselective generation of ester enolates». Tetrahedron Lett. 16 (46): 3975-3978. doi:10.1016/S0040-4039(00)91213-9.
- ↑ Ireland, R. E.; Mueller, R. H.; Willard, A. K. (1976). «The ester enolate Claisen rearrangement. Stereochemical control through stereoselective enolate formation». Journal of the American Chemical Society 98 (10): 2868. doi:10.1021/ja00426a033.
- ↑ Corey, E (1991). «Highly enantioselective and diastereoselective Ireland-Claisen rearrangement of achiral allylic esters». Journal of the American Chemical Society 113 (10): 4026-4028. doi:10.1021/ja00010a074.
- ↑ Johnson, William Summer; Werthemann, Lucius; Bartlett, William R.; Brocksom, Timothy J.; Li, Tsung-Tee; Faulkner, D. John; Petersen, Michael R. (1 de febrero de 1970). «Simple stereoselective version of the Claisen rearrangement leading to trans-trisubstituted olefinic bonds. Synthesis of squalene». Journal of the American Chemical Society 92 (3): 741-743. ISSN 0002-7863. doi:10.1021/ja00706a074.
- ↑ Fernandes, R. A. (2013). «The Orthoester Johnson–Claisen Rearrangement in the Synthesis of Bioactive Molecules, Natural Products, and Synthetic Intermediates – Recent Advances». European Journal of Organic Chemistry 2014 (14): 2833-2871. doi:10.1002/ejoc.201301033.
- ↑ Srikrishna, A (1995). «Application of microwave heating technique for rapid synthesis of γ,δ-unsaturated esters». Tetrahedron 51 (6): 1809-1816. doi:10.1016/0040-4020(94)01058-8.
- ↑ Galindo, Francisco (2005). «The photochemical rearrangement of aromatic ethers: A review of the Photo-Claisen reaction». Journal of Photochemistry and Photobiology C: Photochemistry Reviews 6: 123-138. doi:10.1016/j.jphotochemrev.2005.08.001.
- ↑ Unión Internacional de Química Pura y Aplicada. «photo-Fries rearrangement». Compendium of Chemical Terminology. Versión en línea (en inglés).
- ↑ Kurth, M. J.; Decker, O. H. W. (1985). «Enantioselective preparation of 3-substituted 4-pentenoic acids via the Claisen rearrangement». J. Org. Chem. 50 (26): 5769-5775. doi:10.1021/jo00350a067.
- ↑ Dauben, W. G.; Michno, D. M. (1977). «Direct oxidation of tertiary allylic alcohols. A simple and effective method for alkylative carbonyl transposition». J. Org. Chem. 42 (4): 682. doi:10.1021/jo00424a023.
- ↑ «(R)-(+)-3,4-Dimethylcyclohex-2-En-1-One». Organic Syntheses 82: 108. 2005. doi:10.15227/orgsyn.082.0108.
- ↑ Chen, B.; Mapp, A. (2005). «Thermal and catalyzed [3,3]-phosphorimidate rearrangements». Journal of the American Chemical Society 127 (18): 6712-6718. PMID 15869293. doi:10.1021/ja050759g.
- ↑ Overman, L. E. (1974). «Thermal and mercuric ion catalyzed [3,3]-sigmatropic rearrangement of allylic trichloroacetimidates. 1,3-Transposition of alcohol and amine functions». Journal of the American Chemical Society 96 (2): 597-599. doi:10.1021/ja00809a054.
- ↑ Overman, L. E. (1976). «A general method for the synthesis of amines by the rearrangement of allylic trichloroacetimidates. 1,3-Transposition of alcohol and amine functions». Journal of the American Chemical Society 98 (10): 2901-2910. doi:10.1021/ja00426a038.
- ↑ «Allylically Transposed Amines from Allylic Alcohols: 3,7-Dimethyl-1,6-Octadien-3-Amine». Organic Syntheses 58: 4. 1978. doi:10.15227/orgsyn.058.0004.
- ↑ Yu, C.-M.; Choi, H.-S.; Lee, J.; Jung, W.-H.; Kim, H.-J. (1996). «Self-regulated molecular rearrangement: Diastereoselective zwitterionic aza-Claisen protocol». J. Chem. Soc., Perkin Trans. 1 (2): 115-116. doi:10.1039/p19960000115.
- ↑ Nubbemeyer, U. (1995). «1,2-Asymmetric Induction in the Zwitterionic Claisen Rearrangement of Allylamines». J. Org. Chem. 60 (12): 3773-3780. doi:10.1021/jo00117a032.
- ↑ Ganem, B. (1996). «The Mechanism of the Claisen Rearrangement: Déjà Vu All over Again». Angew. Chem. Int. Ed. Engl. 35 (9): 936-945. doi:10.1002/anie.199609361.