Entamoeba histolytica
Entamoeba histolytica es una ameba parásita anaerobia con forma ameboide, como su nombre lo indica, dentro del género Entamoeba. Es patógeno para el ser humano y para los cánidos, causando amebiasis incluyendo colitis amébica y absceso hepático. La infección por E. histolytica puede desarrollarse de forma asintomática o puede producir alguna de las enfermedades ya mencionadas. La mayoría de infecciones que se producen son asintomáticas, pero cuando se producen infecciones invasivas, estas conllevan consecuencias muy graves para el huésped. Por ejemplo, la colitis amébica es una de las principales causas de diarrea en el mundo, sobre todo en países en vías de desarrollo donde es clasificada en el top 15 de las causas de diarrea durante los primeros dos años de vida. Además, este patógeno también puede causar infecciones extraintestinales, mayormente abscesos hepáticos, que provocarán complicaciones mucho más graves que pueden incluso llevar a la muerte. Por estas razones, y por su facilidad de diseminación y contagio, es clasificado dentro de la categoría B de patógeno de prioridad de biodefensa por el National Institute of Allergy and Infectious Diseases (NIAID).[1][2]
| Entamoeba histolytica | ||
|---|---|---|
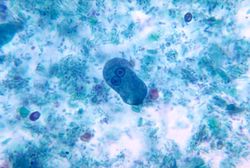 Trofozoito de Entamoeba histolytica | ||
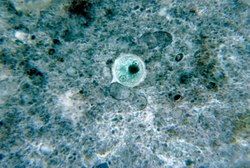 Quiste de Entamoeba histolytica | ||
| Taxonomía | ||
| Dominio: | Eukaryota | |
| Reino: | Protista | |
| Filo: | Amoebozoa | |
| Clase: | Archamoebae | |
| Orden: | Mastigamoebida | |
| Familia: | Entamoebidae | |
| Género: | Entamoeba | |
| Especie: |
Entamoeba histolytica Schaudinn 1903 | |
Morfología editar
En la Entamoeba histolytica se pueden distinguir varias formas o fases de desarrollo en esta especie, presentes durante varias etapas de su ciclo de vida:
- Trofozoíto: es la forma activamente móvil de la especie. Se caracteriza por tener un núcleo con una concentración de cromatina puntiforme y generalmente concéntrica llamado cariosoma central; así como la formación de cromatina en la periferia del núcleo.
- Forma magna: tipo de trofozoíto muy patógeno, causante de la disentería amebiana. Mide de 20 a 30 μm e ingiere glóbulos rojos. Vive en los tejidos del intestino. Está rodeada por la emisión de notables pseudópodos que le permiten motilidad continua. La presencia de pseudópodos es una de las maneras de distinguir E. histolytica con otra especie común en el hombre, Entamoeba coli, que carece de pseudópodos.
- Forma minuta: trofozoíto no patógeno, forma natural de Entamoeba histolytica, que mide de 10 a 20 μm y no ingiere glóbulos rojos. Vive en la luz intestinal como comensal. Tiene pseudópodos, aunque más cortos y delgados que la forma magna.
- Quiste: forma infectante, mide de 10 a 15 µm. Contiene de 1 a 4 núcleos, dependiendo de la madurez del quiste. Son de forma redondeada y circular, refringente con una membrana claramente demarcada. En el citoplasma se pueden ver con frecuencia de 1 a 3 inclusiones de glucógeno oscuras llamadas cuerpos cromatidales.
- Metaquiste: tienen las mismas características que los quistes, por derivarse de estos durante el proceso de desenquistamiento en la luz del colon proximal. Son los metaquistes los que darán origen a los trofozoítos, por lo que tienen una membrana más irregular y delgada que un quiste.
Fisiología editar
Entamoeba histolytica se alimenta del bolo alimentario, bacterias intestinales, líquidos intracelulares de las células que destruye y además, a veces fagocita los eritrocitos. Tiene proteínas membranales capaces de formar poros en las membranas de las células humanas, destruyéndolas por choque osmótico, y adhesinas que le permite fijarse a las células de la mucosa, de modo que no sean arrastradas por la diarrea. Además, producen enzimas proteasas de cisteína, que degradan el medio extracelular humano, permitiéndole invadir otros órganos.
Trofozoíto editar
Su tamaño varía entre 15 y 60 µm de diámetro. Su cuerpo se encuentra formado por un protoplasma, el cual se divide en dos partes: el ectoplasma claro e hialino que se usa para formar los seudopodos, y el endoplasma de estructura granular.
Quiste editar
Esta es la forma de resistencia y multiplicación. Pasa ileso por la ácida barrera del estómago, pasa sin sufrir modificaciones a través del duodeno y el resto del intestino delgado, donde ocurre un desenquistamiento en el cual la cubierta de quitina del quiste se rompe liberando cuatro células, las cuales se dividen inmediatamente originando las formas infectantes.
Hay varias clases, la mayoría prácticamente inocuas, pero algunas son altamente patógenas. La infección generalmente no genera inmunidad posterior.
Ciclo de vida editar
El hábitat de Entamoeba histolytica es la pared y la luz del colon, en especial el ciego, ascendente y el rectosigmoide, lugar donde por lo general ocurre la estasis fecal.
Su ciclo de vida es directo (un solo hospedador). Cuando los quistes maduros son ingeridos por un hospedador, estos se desenquistan en el intestino delgado dando lugar a los trofozoítos. Los trofozoítos se multiplican por fisión binaria y se desplazan hacia el intestino grueso; a medida que avanzan hacia el exterior dejan de alimentarse y se rodean de una pared resistente transformándose así en quistes. Tanto los quistes como los trofozoítos son eliminados en las heces del hospedador. Una vez en el exterior, los trofozoítos apenas sobreviven, y, aunque sean rápidamente ingeridos por un hospedador no son capaces de sobrevivir a la acción de los jugos gástricos. Sin embargo, los quistes sobreviven en el exterior desde horas hasta meses en función de las condiciones ambientales, pero solo los quistes maduros son infecciosos
Epidemiología editar
Según la OMS, hay 50 millones de nuevas infecciones por año y 70 000 muertes. La disentería amébica se presenta frecuentemente en países tropicales aunque también se presentan casos en las zonas templadas y frías. En África, Asia tropical y América latina, más de dos tercios de la población presenta estos parásitos intestinales, a pesar de que la mayoría de las infecciones pueden ser prácticamente asintomáticas. En Europa y Estados Unidos menos del 5 % de la población es portadora. Entamoeba histolytica afecta a los primates; los casos en perros y gatos son relativamente raros.
- Modo de transmisión: ruta fecal-oral o por contacto sexual/anal.
- Fuente de infección: el hombre infectado, esté enfermo o asintomático (portador sano).
- Hospedador susceptible: cualquier individuo sano, en especial los niños menores de dos años y preescolares en condiciones socioeconómicas desfavorables.
La infección ocurre por la contaminación del agua, vegetales, frutas u otros alimentos crudos mal lavados o mal cocinados con quistes infecciosos provenientes de heces contaminadas. Es posible que moscas y cucarachas transporten quistes, desde las heces hasta los alimentos. La contaminación fecal-oral por algunas prácticas sexuales también es una fuente de infecciones importante. Los quistes son resistentes, sobreviviendo varias semanas, pero mueren a alta temperatura o con agua caliente.
- Forma parasitaria de eliminación: los trofozoítos mueren con rapidez en el medio ambiente, mientras que los quistes son la forma de resistencia al medio externo e infectante para el hombre susceptible.
- Medio de eliminación: las heces de personas infectadas a través de la puerta de salida, que es el ano.
- Forma parasitaria de infección: los quistes maduros (tetranucleados) ingeridos por la vía oral pasiva y mucho más raramente por intimidad sexual entre seres humanos.
La prevalencia de la amebiasis al igual que casi todas las enfermedades entéricas, varía según el grado de sanidad, y en general es mayor en las regiones tropicales y subtropicales que en los climas templados. Así mismo tanto la gravedad del padecimiento como la frecuencia de complicaciones son mayores en los trópicos.
La amebiasis es común en las zonas rurales y en los grupos socioeconómicos más bajos, Sin embargo, tratándose de cualquier región, este padecimiento es más frecuente en los sitios dónde predomina el hacinamiento y puede alcanzar proporciones epidémicas en orfanatos, prisiones y asilos.
Desde un punto de vista epidemiológico, es importante diferenciar entre las etapas de infección aguda, crónica y asintomática (o de portador de quistes). La disentería amibiana aguda no tiene importancia en lo que se refiere a transmisión de la enfermedad, ya que los trofozoítos no pueden sobrevivir durante mucho tiempo fuera del huésped. Los sujetos con infección crónica eliminan trofozoítos o quistes en diferentes momentos, en tanto que los pacientes asintomáticos suelen producir solo quistes, los cuales tienen la mayor importancia para la transmisión del padecimiento, así como una resistencia relativa aunque se destruyen con técnicas de secado, temperaturas superiores a 55 °C y cloración de adición de yodo al agua potable. En tanto que en muchas regiones la fuente primaria de infección es el agua contaminada, también lo son las personas que manejan alimentos. En otras regiones el “riego nocturno” con excremento humano para fertilizar, la contaminación de alimentos a partir de moscas y, tal vez, cucarachas tienen importancia epidemiológica para la transmisión.[3]
Patogenia editar
Gran parte del armamento enzimático que se estima que emplea Entamoeba histolytica y que probablemente le confiere su modo de acción patogénica lo coloca entre los organismos llamados Zimodemo II.[4] Se piensa que la presencia en el organismo o la capacidad de uso mayor o menor de dicho armamento enzimático confieren a las diferentes cepas sus características virulentas, siendo más dañinas las que combinen el mayor número de estos componentes. En efecto, el uso de ese repertorio enzimático del grupo Zimodemo II es el método más común para diferenciar entre un organismo patógeno o no patógeno de Entamoeba histolytica.[5] Algunos de los factores patogénicos principales que aumentan la capacidad de causar daño al hospedador humano, son:
- Actividad colagenasa. Los trofozoítos tienen propiedades secretoras bioquímicas con actividad de proteasas, que degradan el colágeno, como en el tejido hepático,[6] pudiendo ser ese uno de los métodos para la formación de los abscesos hepáticos.
- Enzimas proteolíticas. Además de colagenasas, se ha demostrado la acción de una enzima citotóxica muy parecida a la catepsina B llamada EhCP112,[7] implicada en la disolución de la matriz intercelular que mantiene unidas las células de la mucosa epitelial. Tiene también un efecto destructivo en contra de ciertas células en el cuerpo leucocitarias.
- Proteínas formadoras de poros. La producción de estas moléculas ocasionan lisis en la célula diana por medio de cambios osmóticos.
- Sustancias neurohormonales. Se les ha culpado de conferir a ciertas cepas la facultad de crear disturbios en el transporte intestinal de electrolitos, cualidad de las diarreas perdedoras de volumen.
- La lectina galactosa/N-acetilgalactosamina (Gal/GalNAc, 260 kDa) está involucrada en el proceso de adhesión a mucinas, eritrocitos, neutrófilos, bacterias y células epiteliales.
Otras moléculas se han asociado al proceso de adhesión. Los trofozoitos expresan lipofosfoglucano (EhLPPG) en su membrana, y también juega un papel en la adhesión.
Recientemente se ha encontrado que la proteína EhRhoGAPnc, que se encuentra sobreexpresada en E. histolytica en comparación con otras especies no patogénicas del mismo género (E. dispar),[8] es capaz de controlar la patogénesis de este protozoo mediante su interacción con EhRacC y EhRacD que controlan la adhesión a los epitelios tan necesaria para la infección por parte de este patógeno.[9]
Patología editar
Las lesiones por E. histolytica pueden ser intestinales o extraintestinales potencialmente involucrando a varios órganos.
Lesiones intestinales editar
La patología intestinal ocurre principalmente en cualquier parte del colon, en particular el ciego, sigmoides y el recto.
En el colon el mucus forma la primera barrera y la mucina secretora MUC2 es la principal entre la monocapa de células epiteliales y el contenido luminal, que está cargado de patógenos. Cuando se ingiere la E. histolytica coloniza la capa de moco externa del colon, y sus proteasas escinden la MUC2 en el dominio C no glicosilado, lo que debilita su estructura y facilita el contacto de E. histolytica con las células epiteliales.[10]
La interacción inicial del trofozoíto conlleva a lisis de las células diana, probablemente por acción proteolítica de lectinas.[11] Una vez atravesado el epitelio intestinal, penetra por la capa de la muscularis mucosae e instalados en hábitat en la submucosa, formando una apertura pequeña de entrada con un fondo ancho, que tiene la apariencia histológica de un botón de camisa o en matraz. La reacción inflamatoria resultante en el tejido intestinal producen nódulos que progresan a úlceras y subsecuente necrosis localizada como resultado de trastornos del riego sanguíneo. La resistencia del parásito al ataque del sistema del complemento, hace que pueda sobrevivir en medio de una sobrepoblación infiltrativa de células linfocitarias (células plasmáticas, linfocitos, eosinófilos, etc).[12]
Lesiones extraintestinales editar
Según su frecuencia de aparición, se describen:
- Absceso hepático amebiano, que puede extenderse a la pleura o al pericardio, según la localización del absceso.
- Invasión pulmonar, generalmente originada por contigüidad de las lesiones hepáticas, observándose con más frecuencia en el pulmón derecho. Se caracteriza por necrosis del parénquima pulmonar con posible infección bacteriana secundaria.
- Invasión cerebral, causada por diseminación sanguínea. Es una complicación bastante rara.
- Invasión de la piel, causando úlceras dérmicas, viéndose con más frecuencia en la región perianal, peneal y la pared abdominal.
Avance y síntomas editar
Al comenzar a multiplicarse los trofozoítos la mayoría de las infecciones son controladas por el sistema inmunitario, no habiendo generalmente síntomas, pero sí excreción de quistes infecciosos.
A medida que aumenta el número de parásitos, provocan la destrucción de la mucosa intestinal, con ruptura de los vasos sanguíneos y destrucción de las células caliciformes que almacenan el moco. El sistema inmunitario rechaza su presencia generando focos diseminados de inflamación del intestino. El resultado es la mala absorción de agua y nutrientes de los alimentos (debida a la destrucción de las vellosidades de los enterocitos) con diarrea sanguinolenta y con moco.
Otros síntomas frecuentes son los dolores intestinales, náuseas y vómitos. La formación de úlceras intestinales y las pérdidas de sangre pueden causar anemia por déficit de hierro, especialmente en las mujeres. La disentería amebiana puede ser recurrente, con períodos asintomáticos y sintomáticos, durante muchos años. A veces ocurren infecciones bacterianas asociadas, debido a la fractura de la mucosa del intestino.
Si los parásitos se diseminan por el tracto gastrointestinal, pueden causar otros problemas. En el hígado destruyen hepatocitos y se forma un absceso que al crecer provoca problemas hepáticos. En algunos casos pueden formarse abscesos en el bazo o en el cerebro, con complicaciones muy peligrosas. Síntomas de invasión amebiana sistémica son la fiebre alta ondulante, temblores, y la pérdida del cabello exceso de sudor, dolores abdominales en la zona del hígado, fatiga y hepatomegalia.
Diagnóstico y tratamiento editar
El diagnóstico se logra mediante exámenes de laboratorio de la materia fecal con microscopio óptico. En algunos casos se requiere tomar imágenes del hígado con TAC, o detección del ADN del parásito mediante PCR o serología con detección de anticuerpos específicos.
La afección se trata por prescripción médica de metronidazol, iodoquinol, paromomicina o furoato de diloxanida y tinidazol. Los abscesos hepáticos avanzados pueden requerir de cirugía.
Uno de los principales bactericidas, auxiliar en el tratamiento de patologías relacionadas con el estómago o intestinos incluyendo la Entoamoeba histolytica es el extracto de Castela tortuosa, conocido como "Chaparro Amargo" o "Chaparro Amargoso".
Prevención editar
Hervir el agua, no usar cubos de hielo fuera de casa y no comer sin lavar intensamente ensaladas u otros vegetales crudos o frutas crudas con cáscara en zonas endémicas.
Es además necesario evitar la presencia de heces humanas de los terrenos agrícolas.
Evitar el contacto con mamíferos ya que ellos son portadores de este parásito.
Como tratamiento previo al consumo de tubérculos, que crecen en contacto directo con la tierra, es recomendable la desinfección con agua a la que se añade una pequeñísima cantidad de cal viva. Este procedimiento es normalmente usado en los cultivos hidropónicos. Este método extermina los nematodos, incluso estando estos en la parte central del fruto o vegetales.[13]
Referencias editar
- ↑ Shirley, Debbie-Ann T; Farr, Laura; Watanabe, Koji; Moonah, Shannon (1 de julio de 2018). «A Review of the Global Burden, New Diagnostics, and Current Therapeutics for Amebiasis». Open Forum Infectious Diseases 5 (7). ISSN 2328-8957. doi:10.1093/ofid/ofy161. Consultado el 13 de marzo de 2019.
- ↑ Kantor, Micaella; Abrantes, Anarella; Estevez, Andrea; Schiller, Alan; Torrent, Jose; Gascon, Jose; Hernandez, Robert; Ochner, Christopher (2 de diciembre de 2018). «Entamoeba Histolytica: Updates in Clinical Manifestation, Pathogenesis, and Vaccine Development». Canadian Journal of Gastroenterology and Hepatology 2018: 1-6. ISSN 2291-2789. doi:10.1155/2018/4601420. Consultado el 13 de marzo de 2019.
- ↑ Markel y Voge. Parasitología: Diagnóstico, Prevención y Tratamiento. Ed. Manual moderno, pag 33-34.
- ↑ Amador, F., Jimenez, E. & Kumate J. 1986. Correlación clínica del zimodemo de Entamoeba histolytica en pacientes de un hospital psiquiátrico. Seminario sobre amibiasis. 10, INCONNU, vol. 17, suppl., nº 1, pp. 331-334 (11 ref.) [1] Archivado el 17 de octubre de 2013 en Wayback Machine.
- ↑ Sistema Bibliotecario y de Información de la Universidad del Zulia. [2]
- ↑ Sociedad Mexicana de Bioquímica. [3]
- ↑ Quintas Granados, et al. Activación del precursor de la EhCP112 de Entamoeba histolytica e inhibición específica con su región PREPRO. [4]
- ↑ MacFarlane, R. C.; Singh, U. (20 de diciembre de 2005). «Identification of Differentially Expressed Genes in Virulent and Nonvirulent Entamoeba Species: Potential Implications for Amebic Pathogenesis». Infection and Immunity 74 (1): 340-351. ISSN 0019-9567. doi:10.1128/iai.74.1.340-351.2006. Consultado el 13 de marzo de 2019.
- ↑ Hernandez-Flores, Araceli; Almaraz-Barrera, Ma de Jesus; Lozano-Amado, Daniela; Correa-Basurto, Jose; Rojo-Dominguez, Arturo; Luna-Rivera, Eva; Schnoor, Michael; Guillen, Nancy et al. (25 de mayo de 2016). «A new nucleocytoplasmic RhoGAP protein contributes to control the pathogenicity ofEntamoeba histolyticaby regulating EhRacC and EhRacD activity». Cellular Microbiology 18 (11): 1653-1672. ISSN 1462-5814. doi:10.1111/cmi.12603. Consultado el 13 de marzo de 2019.
- ↑ Leon-Coria A, Kumar M, Moreau F, Chadee K (2018). «Defining cooperative roles for colonic microbiota and Muc2 mucin in mediating innate host defense against Entamoeba histolytica.». PLoS Pathog 14 (11): e1007466. Consultado el 16 de julio de 2019.
- ↑ Centro de Investigación y de Estudios Avanzados del Instituto Politécnico Nacional. [5]
- ↑ Universidad de las Américas Puebla. [6]
- ↑ «Enfermedades parasitarias».
Enlaces externos editar
- Wikimedia Commons alberga una categoría multimedia sobre Entamoeba histolytica.