Abacavir
El sulfato de abacavir, también conocido como 1592U89, es un fármaco sintético análogo de los nucleósidos, inhibidor de la transcriptasa inversa, que es utilizado en el tratamiento contra el VIH, causante del sida. Existe una marca comercial que se expende en combinación con otros fármacos antivirales (abacavir, zidovudina y lamivudina). Fue aprobado para uso público en 1998. Se encuentra en la lista de Medicamentos Esenciales de la OMS.[1]
| Abacavir | ||
|---|---|---|
 | ||
 | ||
| Nombre (IUPAC) sistemático | ||
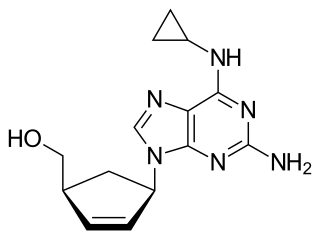
| (1S,4R)-4-[2-amino-6-(ciclopropilamino)- 9H-purina-9-il]-2-ciclopenteno-1-metanol sulfato (sal). | ||
| Identificadores | ||
| Número CAS | 136470-78-5 | |
| Código ATC | J05AF06 | |
| PubChem | 441300 | |
| DrugBank | DB01048 | |
| Datos químicos | ||
| Fórmula | C14H18N6O | |
| Peso mol. | 286.333 | |
| Sinónimos | Ciclopropilaminopurinilciclopenteno | |
| Datos físicos | ||
| P. de fusión | 165 °C (329 °F) | |
| Farmacocinética | ||
| Biodisponibilidad | 83% | |
| Metabolismo | Hígado | |
| Excreción | Renal (1.2% abacavir, 30% 5'-metabolito del ácido carboxílico, 36% 5'-metabolito glucurónido, 15% otros metabolitos menores). Heces (16%) | |
| Datos clínicos | ||
| Cat. embarazo | C | |
| Estado legal | Grupo IV (Medicamentos expedidos mediante receta médica, autorizados para su venta exclusivamente en farmacias.) (MEX) Solo por prescripción | |
| Vías de adm. | Oral | |
Indicaciones editar
El fármaco es usado para tratar el HIV tipo 1 y debe siempre ser utilizado en combinación con otros agentes antirretrovirales. Abacavir jamás debe usarse como único fármaco cuando se cambien los regímenes antirretrovirales debido a pérdida de la respuesta viral.
Mecanismo de acción editar
El abacavir es un análogo de la guanosina (una purina). Su objetivo es la inhibición de la enzima transcriptasa inversa.
Farmacocinética editar
El abacavir se administra por vía oral y posee una elevada biodisponibilidad, de alrededor del 83 %. Es metabolizado por medio de una de dos enzimas, la alcohol deshidrogenasa o por la gluconil transferasa. Se ha observado que el fármaco atraviesa la barrera hematoencefálica. Se considera que alcanza concentraciones en líquido cefalorraquídeo similares a las de zidovudina, por lo que presenta una buena penetración en el sistema nervioso central y por lo que actualmente se hacen pruebas preliminares para ser utilizado en el tratamiento del complejo de demencia asociado al virus de la inmunodeficiencia humana.
Interacciones editar
Se conoce como interacción farmacológica a la modificación del efecto de un fármaco por la acción de otro cuando se administran conjuntamente
| Fármaco | Interacción |
|---|---|
| Analgésicos | El abacavir posiblemente reduce la concentración plasmática de metadona. |
| Antibacterianos | La concentración plasmática de abacavir se reduce posiblemente por la rifampicina. |
| Antiepilépticos | La concentración plasmática de abacavir se reduce posiblemente por la fenitoína.. |
| Antivíricos | La concentración plasmática de abacavir se reduce por el tripanavir. |
| Barbitúricos | La concentración plasmática de abacavir se reduce posiblemente por el fenobarbital.[2] |
Reacciones adversas editar
Una reacción adversa de un fármaco es cualquier reacción nociva no intencionada que aparece a dosis normalmente usadas en el ser humano para profilaxis, diagnóstico o tratamiento o para modificar funciones fisiológicas.[3]
Se ha asociado al fármaco la aparición de una reacción fatal de hipersensibilidad. Los síntomas incluyen fiebre, rash cutáneo, fatiga, síntomas gastrointestinales como náusea, vómito, diarrea o dolor abdominal. Otros síntomas son de tipo respiratorio como faringitis, disnea o tos. La hipersensibilidad está relacionada con el antígeno leucocitario humano HLA-B*5701[4][5] para el cual existe en muchos países occidentales una prueba disponible que permite reducir la incidencia de reacciones de hipersensibilidad debido al HLA-B*5701.[6] El 1 de marzo de 2011, la FDA informó al público sobre una revisión de seguridad en curso del abacavir y un posible aumento del riesgo de ataque cardíaco asociado con el medicamento.[7] Sin embargo, un metanálisis de 26 estudios realizado por la FDA no encontró ninguna asociación entre el uso de abacavir y el ataque cardíaco.[8][9]
Precauciones especiales editar
Los médicos tratantes deben aconsejar a los pacientes[10] que descontinúen el fármaco si aparece un signo posible de alergia o sensibilidad al abacavir, ya que se han presentado casos de fallecimientos debido a esta eventualidad. Otros fallecimientos se han asociado a daño agregado al hígado en personas con problemas hepáticos, ya que esta droga agrava una condición preexistente. Raras veces se ha presentado acidosis láctica con el uso de análogos de nucleósidos.[11]
El uso de fármacos antivirales puede provocar en los pacientes bajo tratamiento una acumulación de la grasa corporal (lipodistrofia),[12] sobre todo en piernas, brazos y en la base del cuello. Abacavir nunca debe ser administrado a niños menores de tres meses.
Carcinogénesis editar
Los estudios de carcinogenicidad realizados con abacavir administrado oralmente en ratones y ratas, mostraron un aumento en la incidencia de tumores tanto malignos como no malignos. Los tumores malignos ocurrieron en la glándula prepucial de los animales machos y en la glándula clitoral de las hembras de ambas especies, y en el hígado, vejiga urinaria, ganglios linfáticos y subcutis de las ratas hembras.[13]
Sobredosificación editar
Son pocos los datos acerca de sobredosificación por abacavir. Las víctimas por sobredosis deben ser llevadas al centro toxicológico local o al departamento de urgencias hospitalarias para instalar un tratamiento. Se aconseja llevar consigo la botella o empaque del medicamento.
Presentaciones y formas farmacéuticas editar
El sulfato de abacavir se presenta en forma de tabletas y solución oral.[14]
- Tabletas conteniendo 300 mg de abacavir. También existen asociaciones con otros antiretrovirales como Lamivudina, conteniendo 300 mg de este último y 600 mg de Abacavir (comercialzado por Humax Pharmaceutical S.A. en Colombia como Lamcavir).
- Solución oral conteniendo 20 mg por mililitro y con sabor artificial agregado.
- Tabletas de 300 mg, comercializado en México con el nombre Vurtas por Landsteiner Scientific - Consulte a su Médico .[15]
Referencias editar
- ↑ «eEML - Electronic Essential Medicines List». list.essentialmeds.org. Consultado el 22 de octubre de 2021.
- ↑ Véase Guía de Prescripción Terapéutica. Información de medicamentos autorizados en España. Archivado el 12 de febrero de 2009 en Wayback Machine. (Revisado el 29 de septiembre de 2008)
- ↑ WHO Chronicle, 1973, 27:476-480.
- ↑ Association between the presence of HLA-B*5701, HLA-DR7 and HLA-DQ3 and hypersensitivity to HIV-1 reverse transcriptase inhibitor abacavir. Autores: Mallal S, Nolan D, Witt C, et al.;Lancet, Vol 359 (2002)
- ↑ Genetic variations in HLA-B region and hypersensitivity reactions to abacavir. Autores: Hetherington S, Hughes AR, Mosteller M y colaboradores. Lancet, Vol 359 (2002).
- ↑ Prospective Screening for Human Leukocyte Antigen-B*5701 Avoids Abacavir Hypersensitivity Reaction in the Ethnically Mixed French HIV Population. Autores: Zucman D, de Truchis P, Majerholc C, et al. J Acquir Immune Defic Syndr; 2007
- ↑ Research, Center for Drug Evaluation and (1 de julio de 2021). «FDA Drug Safety Communication: Safety Review update of Abacavir and possible increased risk of heart attack». FDA (en inglés). Consultado el 22 de octubre de 2021.
- ↑ «FDA Alert: Abacavir - Ongoing Safety Review: Possible Increased Risk of Heart Attack». Drugs.com (en inglés). Consultado el 22 de octubre de 2021.
- ↑ Ding, Xiao; Andraca-Carrera, Eugenio; Cooper, Charles; Miele, Peter; Kornegay, Cynthia; Soukup, Mat; Marcus, Kendall A. (1 de diciembre de 2012). «No Association of Abacavir Use With Myocardial Infarction: Findings of an FDA Meta-Analysis». JAIDS Journal of Acquired Immune Deficiency Syndromes (en inglés estadounidense) 61 (4): 441-447. ISSN 1525-4135. doi:10.1097/QAI.0b013e31826f993c. Consultado el 22 de octubre de 2021.
- ↑ «Abacavir (Ziagen)». patient.info (en inglés). Consultado el 22 de octubre de 2021.
- ↑ «Abacavir - Paciente | NIH». clinicalinfo.hiv.gov. Consultado el 22 de octubre de 2021.
- ↑ «La infección por el VIH y la lipodistrofia | NIH». hivinfo.nih.gov. Consultado el 22 de octubre de 2021.
- ↑ Data On File: Literatura para médicos; GlaxoSmithKline.
- ↑ Datos del sitio web
- ↑ «Listado de productos Landsteiner Scientific». Archivado desde el original el 25 de septiembre de 2015. Consultado el 23 de septiembre de 2015.
- Antirretroviral Therapy-Investigational NRTIs: HIV Clinical Management Vol. 3. Medscape Inc, 1998
- HIV Insite Antirretroviral Drug Database; UC Regents, 1999
Enlaces externos editar
- En MedlinePlus hay más información sobre Abacavir