Adenosín trifosfato
El adenosín trifosfato (ATP) o trifosfato de adenosina (TFA) (en inglés adenosine triphosphate) es un nucleótido fundamental en la obtención de energía celular. Está formado por una base nitrogenada (adenina) unida al carbono uno de un azúcar de tipo pentosa.
| Adenosín trifosfato | ||
|---|---|---|
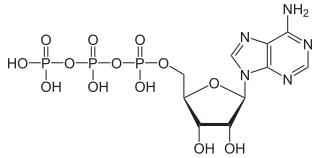 Estructura de trifosfato de adenosina (ATP), protonado. | ||
 Modelo de bolas y varillas del ATP. | ||
| General | ||
| Otros nombres | trifosfato de adenosina | |
| Símbolo químico | ATP o TFA | |
| Fórmula estructural | Ver primera imagen | |
| Fórmula molecular | C10H16N5O13P3 | |
| Identificadores | ||
| ChEBI | 15422 | |
| ChEMBL | CHEMBL14249 | |
| ChemSpider | 5742 | |
| DrugBank | 00171 | |
| PubChem | 5957 | |
| UNII | 8L70Q75FXE | |
| KEGG | C00002 D08646, C00002 | |
Se produce durante la fotofosforilación y la respiración celular, y es consumido por muchas enzimas en la catálisis de numerosos procesos químicos. Su fórmula molecular es C10H16N5O13P3.
Descubrimiento editar
El trifosfato de adenosina fue hallado por primera vez en el músculo humano en 1929 en los Estados Unidos por Cyrus H. Fiske y Yellapragada Subbarao, e independientemente, en Alemania por Karl Lohman.[cita requerida] Sin embargo, hasta diez años más tarde no empezó a reconocerse el papel central del ATP en la transferencia de energía. En 1941, Fritz Lipmann (Premio Nobel, 1953) ayudado por las contribuciones de Herman Kalckar, apuntó la hipótesis de la naturaleza cíclica del papel del ATP en los procesos bioenergéticos escribiendo:
No se pueden dar respuestas definidas a la pregunta de cómo opera el alto potencial del grupo fosfato como promotor de varios procesos, si bien, solo se puede reconocer una interconexión más o menos estrecha con el recambio del fosfato. El ciclo metabólico es comparable a una máquina que genera corriente eléctrica. De hecho, parece que en la organización celular, la «corriente» de fosfato juega un papel similar al de corriente eléctrica en la vida de los seres humanos. Y es también una forma de energía utilizada para todos los fines.[1]
Propiedades químicas editar
El ATP es estable en soluciones acuosas entre pH 6.8 y 7.4, en ausencia de catalizadores. A pH más extremos, se hidroliza rápidamente a ADP y fosfato. Las células vivas mantienen la proporción de ATP a ADP en un punto de diez órdenes de magnitud desde el equilibrio, con concentraciones de ATP cinco veces mayores que la concentración de ADP.[2][3] En el contexto de las reacciones bioquímicas, los enlaces P-O-P se denominan frecuentemente enlaces de alta energía.[4]
La hidrólisis de ATP en ADP y fosfato inorgánico libera 30.5 kJ / mol de entalpía, con un cambio en la energía libre de 3.4 kJ / mol.[5] La energía liberada por la división de una unidad de fosfato (Pi) o pirofosfato (PPi) del ATP en el estado estándar de 1 M es:[6]
- ATP + H2O → ADP + Pi ΔG = −30.5 kJ/mol (−7.3 kcal/mol)
- ATP + H2O → AMP + PPi ΔG = −45.6 kJ/mol (−10.9 kcal/mol)
Producción de AMP y ADP editar
El ATP puede ser producido por varios procesos celulares distintos; Las tres vías principales en eucariotas son (1) glucólisis, (2) el ciclo del ácido cítrico / fosforilación oxidativa, y (3) beta-oxidación. El proceso general de oxidación de glucosa a dióxido de carbono, la combinación de las vías 1 y 2, conocida como respiración celular, produce aproximadamente 30 equivalentes de ATP a partir de cada molécula de glucosa. La producción de ATP en una eucariota aeróbica no fotosintética se produce principalmente en las mitocondrias, que comprenden casi el 25% del volumen de una célula típica.[7]
Glucólisis editar
En la glucólisis, la glucosa y el glicerol se metabolizan a piruvato. La glucólisis genera dos equivalentes de ATP a través de la fosforilación del sustrato catalizada por dos enzimas, PGK y piruvato quinasa. También se producen dos equivalentes de NADH, que pueden oxidarse a través de la cadena de transporte de electrones y dar como resultado la generación de ATP adicional por la ATP sintasa. El piruvato generado como producto final de la glucólisis es un sustrato para el ciclo de Krebs.[8] Se considera que la glucólisis consta de dos fases con cinco pasos cada una. Fase 1, "la fase preparatoria", la glucosa se convierte en 2 d-gliceraldehído-3-fosfato (g3p). Un ATP se invierte en el Paso 1, y otro ATP se invierte en el Paso 3. Los pasos 1 y 3 de la glucólisis se denominan "Pasos de cebado". En la Fase 2, los dos equivalentes de g3p se convierten en dos piruvatos. En el Paso 7, se producen dos ATP. Además, en el Paso 10, se producen otros dos equivalentes de ATP. En los pasos 7 y 10 , el ATP se genera a partir de ADP. Se forma una red de dos ATP en el ciclo de glucólisis. La vía de la glucólisis se asocia más tarde con el ciclo del ácido cítrico que produce equivalentes adicionales de ATP.
Ciclo de Krebs editar
En la mitocondria, el complejo de piruvato deshidrogenasa oxida el piruvato al grupo acetilo, que se oxida completamente a dióxido de carbono mediante el ciclo del ácido cítrico (también conocido como ciclo de Krebs). Cada "giro" del ciclo del ácido cítrico produce dos moléculas de dióxido de carbono, un equivalente de trifosfato de guanosina ATP (GTP) a través de la fosforilación a nivel de sustrato catalizada por la succinil-CoA sintetasa, ya que la succinil-CoA se convierte en succinato, tres equivalentes de NADH , y un equivalente de FADH2. NADH y FADH2 se reciclan (a NAD + y FAD, respectivamente), generando ATP adicional por fosforilación oxidativa. La oxidación de NADH resulta en la síntesis de 2-3 equivalentes de ATP, y la oxidación de un FADH2 produce entre 1-2 equivalentes de ATP.[9] La mayoría del ATP celular es generado por este proceso. Aunque el ciclo del ácido cítrico en sí no involucra oxígeno molecular, es un proceso aeróbico obligatorio porque el O2 se usa para reciclar el NADH y el FADH2. En ausencia de oxígeno, el ciclo del ácido cítrico cesa.[10]
En la fosforilación oxidativa, el paso de electrones desde NADH y FADH2 a través de la cadena de transporte de electrones bombea protones fuera de la matriz mitocondrial hacia el espacio intermembrana. Este bombeo genera una fuerza motriz de protones que es el efecto neto de un gradiente de pH y un gradiente de potencial eléctrico a través de la membrana mitocondrial interna. El flujo de protones por este gradiente potencial, es decir, desde el espacio intermembrana hasta la matriz, produce ATP por la ATP sintasa.[11] Se producen tres ATP por turno. Aunque el consumo de oxígeno parece fundamental para el mantenimiento de la fuerza motriz del protón, en caso de escasez de oxígeno (hipoxia), la acidosis intracelular (mediada por tasas glucolíticas mejoradas e hidrólisis de ATP), contribuye al potencial de membrana mitocondrial e impulsa directamente la síntesis de ATP.[12]
La mayor parte del ATP sintetizado en las mitocondrias se usará para procesos celulares en el citosol; por lo tanto, debe exportarse desde su sitio de síntesis en la matriz mitocondrial. El movimiento hacia afuera del ATP se ve favorecido por el potencial electroquímico de la membrana porque el citosol tiene una carga relativamente positiva en comparación con la matriz relativamente negativa. Por cada ATP transportado, cuesta 1 H +. Un ATP cuesta alrededor de 3 H +. Por lo tanto, hacer y exportar un ATP requiere 4H +. La membrana interna contiene un antiportador, el translocase ADP / ATP, que es una proteína de membrana integral utilizada para intercambiar ATP recién sintetizado en la matriz por ADP en el espacio intermembrana.[13] Este translocase es impulsado por el potencial de membrana, ya que da como resultado el movimiento de aproximadamente 4 cargas negativas fuera de la membrana mitocondrial a cambio de 3 cargas negativas movidas dentro. Sin embargo, también es necesario transportar fosfato a la mitocondria; el portador de fosfato mueve un protón con cada fosfato, disipando parcialmente el gradiente de protones. Después de completar la glucólisis, el ciclo del ácido cítrico, la cadena de transporte de electrones y la fosforilación oxidativa, se producen aproximadamente 30-38 ATP por glucosa.
Beta oxidación editar
En presencia de aire y varios cofactores y enzimas, los ácidos grasos se convierten en acetil-CoA. La vía se llama beta-oxidación. Cada ciclo de beta-oxidación acorta la cadena de ácidos grasos en dos átomos de carbono y produce un equivalente cada uno de acetil-CoA, NADH y FADH2. El acetil-CoA es metabolizado por el ciclo del ácido cítrico para generar ATP, mientras que el NADH y el FADH2 se utilizan por fosforilación oxidativa para generar ATP. Decenas de equivalentes de ATP son generados por la beta-oxidación de una sola cadena larga de acilo.[14]
Función en la fotosíntesis editar
Entre las reacciones químicas de la fotosíntesis de las plantas, la clorofila utiliza la luz del sol para impulsar una cadena de reacciones que almacena la energía, en forma de energía química, en la molécula cargada de energía del ATP. La energía química guardada en el ATP es utilizada por la planta en muchas reacciones químicas cuando la planta necesita energía para impulsar una reacción de este tipo, y muchas veces la toma del ATP, que al cederla se "gasta" (se transforma en una molécula de más baja energía llamada ADP). La planta puede utilizar muchas moléculas como fuente de energía química (por ejemplo puede utilizar las moléculas de almacenamiento, como el almidón de las plantas terrestres, o las de transporte, la sacarosa), pero muchas veces, como primer paso, la molécula seleccionada para esto debe transferirle su energía al ATP: mediante unas reacciones químicas la molécula pierde su energía química y a cambio el ADP se carga de energía química en forma de ATP.[15]
De los productos de la fotosíntesis, el oxígeno no se utiliza y es liberado al medio. A partir de los productos de la fotosíntesis, se pueden continuar las reacciones químicas de biosíntesis para construir todas las demás moléculas que necesita la planta (anabolismo). La glucosa y sus derivados, son utilizados por la planta de dos maneras: por un lado los utiliza como componentes estructurales, con los que se forma el cuerpo físico de cada célula de la planta (en forma de celulosa); y por otro lado, los utiliza como fuente de energía química, por ejemplo para formar más ATP cuando este escasea. Si bien, durante el proceso de fotosíntesis, la planta toma algo de la energía de la luz del Sol para formar ATP, ésta no le alcanza para cubrir sus necesidades (en especial en los momentos en que la planta no está expuesta a la luz, y en los órganos que no son fotosintéticos), por lo que debe recurrir a la glucosa y otros derivados almacenados o transportados para utilizarlos como fuente de energía química, principalmente en el proceso llamado respiración celular, donde las plantas también respiran oxígeno.
Hidrólisis editar
Se puede representar como A-P~P~P, donde °~°°~° son los enlaces anhídrido de ácido, que son de alta energía. En la hidrólisis del ATP se está hidrolizando uno de esos enlaces anhídrido de ácido. La formación de nuevos enlaces en la hidrólisis permite la liberación de gran energía, exactamente 7,7 kcal/mol. Es decir:
- ΔG = -7,7 kcal/mol o -31 KJ/mol aproximadamente, que es lo mismo.
Es una reacción muy exergónica. Su es 11.
Así se comprende que el ATP tiene tendencia a hidrolizarse de forma natural y liberar energía.
Razones químicas de la tendencia a la hidrólisis editar
Las razones químicas de esa tendencia son tres:
- Energía de estabilización por resonancia: viene dada por la deslocalización electrónica, es decir, que debido a la distinta electronegatividad entre el P y el O, existe un desplazamiento de los electrones de los dobles enlaces hacia el O. En el enlace doble tienen cierto carácter de sencillo y viceversa.
La energía de estabilización por resonancia es más alta en los productos de hidrólisis que en el ATP. Esto se debe fundamentalmente a que los electrones π (los puntos rojos en los O) de los oxígenos puente entre los P son fuertemente atraídos por los grupos fosfóricos.
La competencia por los electrones π crea una tensión en la molécula evidentemente menor (o está ausente) en los productos de hidrólisis. Por lo tanto, hay mayor energía de estabilización por resonancia en los productos de hidrólisis. - Tensión eléctrica entre las cargas negativas vecinas existente en el ATP (las flechas entre los O de los Pi). Esa tensión es evidentemente menor en los productos de hidrólisis.
- Solvatación: la tendencia natural es hacia una mayor solvatación. La energía de solvatación es mayor en los productos de hidrólisis que en el ATP.
En la célula existen muchos enlaces de alta energía, la mayoría de los cuales son enlaces fosfato. El ATP ocupa una posición intermedia entre los fosfatos de alta energía.
Una de las más importantes funciones del ATP es que almacena, en forma de energía potencial química, gran cantidad de energía para las funciones biológicas, y se liberan cuando uno o dos de los fosfatos se separan de las moléculas de ATP.
Véase también editar
Referencias editar
- ↑ Amstong, Frank; Bennett, Thomas (1982). Biochemistry. biblioteca UNAM: Oxford University. p. 232. ISBN -84-291-7008-1.
- ↑ Ferguson, S. J.; Nicholls, David; Ferguson, Stuart (2002). CA: Academic., ed. Bioenergetics 3. San Diego, CA. ISBN 978-0-12-518121-1.
- ↑ Berg, J. M.; Tymoczko, J. L.; Stryer, L. (2003). Biochemistry. New York, NY. ISBN 978-0-7167-4684-3.
- ↑ Chance, B.; Lees, H.; Postgate, J. G. (1972). "The Meaning of "Reversed Electron Flow" and "High Energy Electron" in Biochemistry". Nature. p. 238 (5363): 330–331.
- ↑ Gajewski, E.; Steckler, D.; Goldberg, R. (1986). "Thermodynamics of the hydrolysis of adenosine 5′-triphosphate to adenosine 5′-diphosphate" (PDF).
- ↑ Berg, Jeremy M.; Tymoczko, John L.; Stryer, Lubert (2007). Biochemistry (6th ed.). New York, NY. p. p. 413. ISBN 978-0-7167-8724-2.
- ↑ Rich, P. R. (2003). "The molecular machinery of Keilin's respiratory chain". Biochem. Soc. Trans. 31 (6):. p. 1095–1105.
- ↑ Voet, D.; Voet, J. G. (2004). Biochemistry. 1 (3rd ed.). Hoboken, NJ: Wiley. ISBN 978-0-471-19350-0.
- ↑ Rich, P. R. (2003). The molecular machinery of Keilin's respiratory chain". Biochem. Soc. Trans. 31 (6): 1095–1105. doi:10.1042/BST0311095. PMID 14641005.
- ↑ Lodish, H.; Berk, A.; Matsudaira, P.; Kaiser, C. A.; Krieger, M.; Scott, M. P.; Zipursky, S. L.; Darnell, J. (2004). Molecular Cell Biology (5th ed.). New York, NY: W. H. Freeman. ISBN 978-0-7167-4366-8.
- ↑ Abrahams, J.; Leslie, A.; Lutter, R.; Walker, J. (1994). "Structure at 2.8 Å resolution of F1-ATPase from bovine heart mitochondria". Nature. p. 370 (6491): 621–628. doi:10.1038/370621a0. PMID 8065448.
- ↑ Devaux, JBL; Hedges, CP; Hickey, AJR (2019). "Acidosis Maintains the Function of Brain Mitochondria in Hypoxia-Tolerant Triplefin Fish: A Strategy to Survive Acute Hypoxic Exposure?". Front Physiol. 9, 1914. p. doi:10.3389/fphys.2019.01941. PMC 6346031. PMID 30713504.
- ↑ Dahout-Gonzalez, C.; Nury, H.; Trézéguet, V.; Lauquin, G.; Pebay-Peyroula, E.; Brandolin, G. (2006). "Molecular, functional, and pathological aspects of the mitochondrial ADP/ATP carrier". Physiology. 21 (4): 242–249.
- ↑ Ronnett, G.; Kim, E.; Landree, L.; Tu, Y. (2005). Fatty acid metabolism as a target for obesity treatment". Physiol. Behav. 85 (1): 25–35. doi:10.1016/j.physbeh.2005.04.014. PMID 15878185.
- ↑ Johnson, Alexander; Alberts, Bruce (2002). Molecular Biology of the Cell. New York: Garland Science. pp. Chapter 2.
Enlaces externos editar
- Adenosina trifosfato (ATP), artículo en Coenzima.com
- Amstrong Frank, Bennett Thomas. Biochemistry. Oxford University Press. New York. 1982. Páginas 523, página consultada 232.