Carbonato de magnesio
| Carbonato de magnesio | |
|---|---|
| General | |
| Imagen | 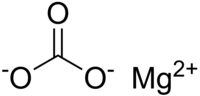
|
| Otros nombres | sal anhidra: Magnesita dihidrato: Barringtonita trihidrato: Nesquehonita pentahidrato: Lansfordita |
| Fórmula molecular | MgCO3 |
| Masa molar | 84.3142 g/mol |
| Aspecto | Sólido blanco |
| Número CAS | [546-93-0] |
| Propiedades | |
| Densidad y estado | 2.958 g/cm³, sólido |
| Solubilidad en agua | 10.6 mg/100 mL |
| Punto de fusión | 350 °C decomp. |
| Estructura | |
| Geometría de coordinación |
? |
| Estructura cristalina | Trigonal |
| Datos termodinámicos | |
| Entalpía estándar de formación ΔfH°sólido |
-1111.69 kJ/mol |
| Entropía molar estándar S°sólido |
65.84 J.K−1.mol−1 |
| Datos de seguridad | |
| Clasificación EU | no listado |
| Punto de ignición | no inflamable |
| Número RTECS | OM2470000 |
| Página de datos suplementarios | |
| Estructura y propiedades |
n, εr, etc. |
| Datos termodinámicos |
Comportamiento de estado Sólido, líquido, gaseoso |
| Datos espectrales | UV, IR, NMR, MS |
| Compuestos relacionados | |
| Otros cationes | Carbonato de calcio Carbonato de estroncio Carbonato de bario |
| Compuestos relacionados | Artenita Hidromagnesita Dipingita |
| Excepto donde diga lo contrario, los datos son de materiales en su estado natural (a 25 °C, 100 kPa) | |
El carbonato de magnesio es un compuesto químico de fórmula MgCO3. Este sólido blanco existe en la naturaleza como mineral. Existen también varias formas hidratadas y básicas del carbonato de magnesio como minerales. Adicionalmente, el MgCO3 tiene varias aplicaciones y usos.
Propiedades editar
Las formas más comunes de carbonato de magnesio son la sal anhidra llamada magnesita (MgCO3) y el di, tri y penta hidratos conocidos como barringtonita (MgCO3·2H2O), nesquehonita (MgCO3·3H2O), y lansfordita (MgCO3·5H2O), respectivamente. Algunas formas básicas como la artinita (MgCO3·Mg(OH)2·3H2O), hidromagnestita (4MgCO3·Mg(OH)2·4H2O), y dipingita (4MgCO3· Mg(OH)2·5H2O) también existen como minerales. La magnesita está compuesta por cristales trigonales blancos. La sal anhidra es prácticamente insoluble en agua, acetona, y amoníaco. Todas las demás formas de carbonato de magnesio se disuelven en ácidos. El carbonato de magnesio cristaliza en la estructura de calcita donde el Mg2+ está rodeado por seis átomos de oxígeno. El dihidrato tiene una estructura triclínica, mientras el trihidrato tiene una estructura monoclínica. El pentahidrato es un sólido cristalino blanco con cristales monoclínicos.
Reacciones editar
A pesar de que el carbonato de magnesio es obtenido normalmente por explotación minera del mineral magnesita, la sal trihidratada, MgCO3·3H2O, puede ser preparada mezclando soluciones de magnesio e iones de carbonato en atmósfera de dióxido de carbono.
El carbonato de magnesio también puede ser sintetizado exponiendo hidróxido de magnesio a dióxido de carbono bajo presión de 3,5 a 5 atm y a 50 °C, lo cual produce bicarbonato de magnesio soluble:
- Mg(OH)2 + 2CO2 → Mg(HCO3)2
Luego del filtrado de la solución, este es secado al vacío para producir carbonato de magnesio en la forma de sal hidratada:
- Mg2+ + 2HCO3- → MgCO3 + CO2 + H2O
Cuando es disuelto con ácido, el carbonato de magnesio se descompone liberando dióxido de carbono:
- MgCO3 + 2HCl → MgCl2 + CO2 + H2O
- MgCO3 + H2SO4 → MgSO4 + CO2 + H2O
A altas temperaturas el MgCO3 se descompone en óxido de magnesio y dióxido de carbono. Este proceso es llamado calcinación:
- MgCO3 → MgO + CO2
Usos editar
Los minerales de magnesita y dolomita son utilizados para producir magnesio y ladrillos refractarios básicos. El MgCO3 es también utilizado en compuestos a prueba de fuego y extintores, cosméticos y dentífricos. Otras aplicaciones son de material de relleno, supresor de humo en plásticos, agente reforzante en goma de neopreno, como agente de secado, laxante y para retener el color en las comidas. Adicionalmente, el carbonato de magnesio de alta pureza es utilizado como antiácido y como aditivo para la sal de mesa, para que escurra mejor.
En 1911 MgCO3 fue agregado por primera vez a la sal para hacerla más escurridiza.[1]
El carbonato de magnesio, conocido más comúnmente como tiza es utilizado para secar las manos en escalada, gimnasia, lanzamiento de bala, levantamiento de potencia y halterofilia.
Referencias editar
- ↑ «Morton Salt FAQ». Archivado desde el original el 11 de julio de 2007. Consultado el 14 de mayo de 2007.
- Patnaik, Pradyot (2003). Handbook of Inorganic Chemicals. New York: McGraw Hill.
- Trotman-Dickenson, A.F "(ed.)" (1973). Comprehensive Inorganic Chemistry. Oxford: Pergamon Press.