Fuga espontánea de líquido cefalorraquídeo
Una fuga espontánea de líquido cefalorraquídeo es una condición médica en la cual el líquido cefalorraquídeo (LCR) que rodea el cerebro humano y la médula espinal gotea, escapándose sin ningún motivo aparente del saco dural que los rodea y los protege. La duramadre, un tejido duro e inflexible, es la capa que se encuentra más en el exterior de las tres capas de las meninges, el sistema de membranas que rodean el cerebro y la médula espinal.
| Fuga espontánea de líquido cefalorraquídeo | ||
|---|---|---|
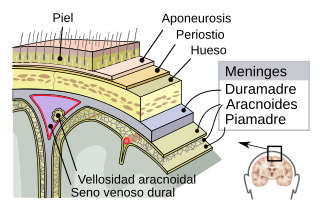 Las meninges espinales del sistema nervioso central. La duramadre y la aracnoides almacenan el LCR y se ven afectadas por el síndrome de la fuga espontánea de líquido cefalorraquídeo. | ||
| Especialidad | neurología | |
Una fuga de LCR espontánea surge idiopáticamente, al contrario de lo que ocurre con las fugas de LCR producidas por traumatismos. Es uno de los varios tipos de fugas de líquido cefalorraquídeo, y ocurre debido a la presencia de uno o más agujeros en la duramadre. Si se pierde LCR a una velocidad más rápida de la que se produce, el volumen dentro del cráneo disminuye, lo que se conoce como hipotensión intracraneal. Lo más común cuando se da una fuga de LCR es sufrir de cefaleas ortostáticas, dolores de cabeza que empeoran cuando el paciente se encuentra en una posición vertical y que mejoran cuando se encuentra acostado. También se puede sufrir dolor o tensión en el cuello, náuseas, vómitos, mareos, fatiga y un sabor metálico en la boca. Mediante un TAC se puede identificar la posición del escape de fluido cefalorraquídeo. Una vez identificado, se puede arreglar la fuga con un parche hemático epidural, una inyección de la sangre del propio paciente en el lugar de la fuga, una inyección de pegamento de fibrina, o mediante una cirugía. Cuando no se puede identificar la causa, el conjunto de los síntomas que se producen se conocen como síndrome de la fuga espontánea de líquido cefalorraquídeo.
El síndrome de la fuga espontánea de líquido cefalorraquídeo afecta a 5 de cada 100.000 personas. Esta enfermedad se desarrolla de media a los 42 años de edad, y las mujeres tienen el doble de probabilidades de desarrollar esta enfermedad en comparación con los hombres. Algunas personas que tienen el síndrome de la fuga espontánea de líquido cefalorraquídeo pierden fluido cefalorraquídeo de forma crónica a pesar de los intentos de poner parches de forma repetida, lo cual produce discapacidad a largo plazo debido al dolor. El neurólogo alemán Georg Schaltenbrand y el médico estadounidense Henry Woltman de la Clínica Mayo fueron los primeros que describieron el síndrome de la fuga espontánea de líquido cefalorraquídeo, el primero en 1938 y el segundo en la década de 1950.
Clasificación editar
El síndrome de la fuga espontánea de líquido cefalorraquídeo se clasifica en dos tipos principales: fugas craneales[1] y espinales.[2] La gran mayoría de las fugas son espinales.[3]
Las fugas craneales ocurren en la cabeza y, en alguno de estos casos, se puede ver el LCR goteando de la nariz[4][5] o de la oreja.[1]
Las fugas espinales ocurren cuando se forman uno o más agujeros en la duramadre a lo largo de la médula espinal.[2]
Las fugas espontáneas de LCR, tanto si son craneales o espinales, producen síntomas neurológicos, hipotensión intracraneal espontánea y la disminución del volumen y de la presión del cráneo.[6] A pesar de que a este síntoma se le suele llamar hipotensión intracraneal, es posible que la presión intracraneal sea normal, y que el problema subyacente real sea un volumen bajo de LCR. Es por esto que al síndrome de la fuga espontánea de líquido cefalorraquídeo se le llama hipovolemia de LCR y no hipotensión de LCR.[7][8][9][10]
Señales y síntomas editar
| Par craneal | Función | Síntomas |
|---|---|---|
| óptico (2) |
quiasma óptico | visión doble o borrosa |
| cuerda del tímpano (Rama del 7) |
sentido del gusto | alteración del sentido del gusto |
| facial (7) |
nervio facial | debilidad y entumecimiento de la cara |
| vestibulococlear (8) |
audición, mantener el equilibrio |
problemas de escucha y de equilibrio |
| glosofaríngeo (9) |
sentido del gusto | alteración del sentido del gusto |
La mayor parte de las personas que contraen el síndrome de la fuga espontánea de LCR sienten la aparición repentina de un dolor de cabeza fuerte e intenso.[10][12] Este dolor de cabeza suele empeorar cuando se está de pie, y por lo general se hace más pronunciado a lo largo del día, doliendo menos cuando se está acostado.[13] Los dolores de cabeza ortostáticos pueden volverse crónicos y convertirse en una discapacidad hasta el punto de provocar incapacidad laboral.[10][14][15][16] Algunos pacientes que tengan síndrome de la fuga espontánea de LCR sufrirán unos dolores de cabeza que se producen específicamente por la tarde. Esto se conoce como dolor de cabeza de la segunda mitad del día, y podría ser una manifestación inicial de una fuga de LCR espontánea o podría ser un síntoma que se ha desarrollado después de recibir tratamiento médico, como por ejemplo un parche epidural, y lo más probable es que indique la presencia de una fuga lenta de LCR.[17]
Además del dolor de cabeza, alrededor de un 50% de los pacientes sufren dolor o tensión en el cuello, náuseas, y vómitos.[18] También pueden sentir mareos y vértigo, debilidad y entumecimiento en la cara, visión doble o borrosa anómala, neuralgia, fatiga o un sabor metálico en la boca.[10] A veces se puede sentir o ver el LCR goteando en forma de secreción por la nariz o por la oreja.[19]
La falta de presión y de volumen de LCR puede hacer que el cerebro se hunda y descienda a través del foramen magno (una abertura de gran tamaño) del hueso occipital, en la base del cráneo. Se cree que la porción inferior del cerebro estira o golpea uno o más complejos de pares craneales, causando así una gran variedad de síntomas sensoriales. Se pueden ver los detalles sobre los pares craneales que pueden sufrir los efectos de este fenómeno y sobre los síntomas relacionados en la tabla de arriba a la derecha.[10][11][16]
Complicaciones editar
Debido al síndrome de la fuga espontánea de LCR, se pueden producir varias complicaciones, como por ejemplo la reducción de la presión craneal, hernias cerebrales, infecciones, problemas de presión sanguínea, parálisis transitorias y la posibilidad de que el paciente entre en coma. La complicación principal (y la más grave) del síndrome de la fuga espontánea de LCR es la hipotensión intracraneal espontánea, en la cual la presión en el cerebro se reduce de forma drástica,[10][20][21] y que produce el distintivo síntoma de los fuertes dolores de cabeza ortostáticos.[11][21]
Las personas que sufren fugas de LCR craneales, la variante menos común, tienen un riesgo de desarrollar meningitis del 10% cada año.[22] Si las fugas craneales duran más de siete días, la probabilidad de contraer meningitis aumenta de forma significativa.[22] Las fugas de LCR espinales no pueden dar lugar a meningitis, ya que la fuga se produce en una zona de condiciones estériles en la cual no puede haber agentes infecciosos.[11] Cuando se produce una fuga de LCR en el hueso temporal, es necesario realizar una cirugía para evitar que se infecte y para reparar la fuga.[23] Otra complicación que puede ocurrir es la hipotensión ortostática (debido a una disfunción autonómica) cuando se produce una disminución significativa de la presión de la sangre.[24] La disfunción autonómica se produce debido a la compresión del tronco del encéfalo, el cual controla la respiración y la circulación.[24]
Un volumen bajo de LCR puede hacer que la amígdala cerebelosa descienda de su posición normal, lo cual se puede confundir fácilmente con la malformación de Chiari; sin embargo, en esta condición "pseudo-Chiari", la amígdala suele volver a su posición normal cuando se cura la fuga de LCR (tal y como se ve en una IRM vertical).[25] Otra complicación posible, aunque más rara, que se podría producir a partir de una fuga de LCR sería una cuadriplejia transitoria debido a la pérdida repentina de una gran cantidad de LCR. Esta pérdida de LCR produce una fuerte compresión de los segmentos cervicales superiores de la médula espinal, y también hernias del rombencéfalo. La cuadriplejia desaparece cuando el paciente se coloca en decúbito supino.[26][26] Otra complicación, extremadamente poco común, del síndrome de la fuga espontánea de LCR es la parálisis del tercer par craneal, problema con el cual puede ser difícil mover los ojos, o incluso ver interrumpida su movilidad, debido a la compresión del tercer par craneal.[27]
Se tiene constancia de casos de demencias frontotemporales y de comas producidos por el síndrome de la fuga espontánea de LCR que son reversibles.[28] Se ha tenido éxito al curar comas producidos por una fuga de LCR usando parches hemáticos y/o pegamento de fibrina, y colocando al paciente en la posición de Trendelenburg.[29] Los pacientes que tienen una fuga de LCR también pueden sufrir el síndrome de la silla turca vacía, relacionado con la estructura ósea que rodea la glándula pituitaria.[30][31]
Causas editar
Una fuga espontánea de LCR es idiopática, lo cual significa que se desconoce la causa.[16][32] En las dos teorías principales se plantea que estas fugas ocurren o bien debido a una enfermedad del tejido conectivo o bien debido a problemas de drenaje espinal.
Teoría del tejido conectivo editar
Varios científicos y médicos han sugerido que el síndrome de la fuga espontánea de LCR puede deberse a una enfermedad del tejido conectivo subyacente que afecta a la duramadre espinal.[10][11][20][33] También puede que se transmita de padres a hijos, y que esté asociado con aneurismas de aorta y con hipermovilidad articular.[11][34]
Hasta dos tercios de las personas que sufren una fuga de LCR manifiestan algún tipo de enfermedad generalizada del tejido conectivo.[11][33] Las tres enfermedades del tejido conectivo asociadas con el síndrome de la fuga espontánea de LCR son el síndrome de Marfan, el síndrome de Ehlers-Danlos y la enfermedad poliquística renal autosómica dominante.[11] Aproximadamente un 20% de los pacientes que tienen el síndrome de la fuga espontánea de LCR presentan características del síndrome de Marfan, entre los que se incluyen estatura alta, pecho hundido (pectus excavatum), hipermovilidad articular y paladar arqueado. Sin embargo, estos pacientes no manifiestan ninguna otra característica del síndrome de Marfan.[11]
Teoría del drenaje espinal editar
En algunos estudios se propone que la causa de algunas fugas de LCR puede estar en problemas con el sistema de drenaje venoso espinal.[35] Según esta teoría, los agujeros en la duramadre y la hipotensión intracraneal son síntomas que se producen debido a una presión venosa baja en el espacio epidural. Cuando los músculos de las extremidades inferiores bombean sangre hacia el corazón y la presión en la vena cava inferior se vuelve negativa, la red de venas epidurales se drena de más, lo cual hace que el LCR sea aspirado al espacio epidural. Se pueden producir fugas verdaderas en los puntos débiles de las meninges espinales. Por lo tanto, la hipotensión de LCR observada se debe a una hipovolemia de LCR y a una presión venosa epidural reducida.[35]
Otras causas editar
En la gran mayoría de los casos, las fugas de LCR craneales ocurren debido a hipertensión intracraneal. Esta presión mayor de lo normal hace que la duramadre craneal se rompa, produciendo fugas de LCR e hipotensión intracraneal.[30][36] Los pacientes que tienen la raíz de un nervio desnuda (es decir, que falta el recubrimiento de la raíz) tienen un riesgo mayor de sufrir fugas de LCR recurrentes.[37] Se conoce al menos un caso de hernias discales que causan fugas de LCR.[38] Las enfermedades degenerativas del disco intervertebral hacen que un disco perfore la duramadre, lo cual produce una fuga del LCR.[11]
Fisiopatología editar
Los plexos coroideos producen líquido cefalorraquídeo en los ventrículos cerebrales, y las membranas duramadre y aracnoides de las meninges lo contienen.[10][20][39] El cerebro flota en LCR, el cual también transporta nutrientes al cerebro y a la médula espinal. Al formarse agujeros en la duramadre espinal, el LCR se escapa al espacio que lo rodea; en ese momento, el LCR es absorbido por los tejidos blandos que rodean la médula espinal o por los plexos venosos espinales epidurales.[11][40] Dado que los tejidos blandos que rodean la médula espinal se encuentran en un ambiente estéril, no existe ningún riesgo de contraer meningitis.[11]
Diagnóstico editar
La sala de urgencias del hospital es el lugar principal en el que el paciente se queja por primera vez al médico del problema.[12][41] Hasta el 94% de las personas que sufren el síndrome de la fuga espontánea de LCR reciben al principio un diagnóstico incorrecto. Entre estos diagnósticos equivocados se encuentran las migrañas, la meningitis, la malformación de Chiari y distintas enfermedades psiquiátricas. De media, pasan 13 meses desde que aparecen los síntomas hasta que se obtiene un diagnóstico definitivo.[42] En un estudio realizado en 2007 se descubrió que había una tasa de éxito del 0% de obtener un diagnóstico correcto en los servicios de urgencias.[41]
Se puede realizar un diagnóstico de fuga de LCR mediante distintas técnicas de imagenología, mediante análisis químicos de los fluidos corporales que se han expulsado a través de un agujero en la cabeza, o mediante un examen clínico. Los análisis instrumentales más comunes para detectar una fuga de LCR son el TC, el IRM y los ensayos químicos. Muchas fugas de LCR no se detectan en imágenes ni en ensayos químicos, por lo que estas técnicas de diagnóstico no son métodos definitivos para descartar fugas de LCR. El médico suele depender a menudo del historial del paciente y de un examen para realizar el diagnóstico; por ejemplo, la secreción de una cantidad excesiva de un fluido transparente en la nariz cuando uno se inclina, el aumento del dolor de cabeza tras recibir una maniobra de Valsalva o la reducción del dolor de cabeza cuando el paciente se pone boca abajo son indicadores claros de una fuga de LCR.
Es bastante común utilizar un examen clínico para diagnosticar fugas de LCR. Si un paciente responde bien a un tratamiento más cauteloso, eso puede ser una señal que puede ayudar a establecer un diagnóstico definitivo. El obstáculo más grande para obtener un diagnóstico y un tratamiento correcto es la falta de conocimiento entre la comunidad clínica de los signos -síntomas y dolencias- de la fuga de LCR; en particular, la pérdida de la característica ortostática de la cefalea y el hecho de que cada persona que tiene fugas de LCR crónicas tendrán un conjunto de síntomas único que, de forma conjunta, contribuyen a la enfermedad subyacente, y al diagnóstico, de una fuga de LCR.
TAC editar
Se puede realizar el diagnóstico de una fuga de líquido cefalorraquídeo combinando la medición de la presión de LCR con una búsqueda de fugas de fluido en la espina dorsal mediante mielografía por tomografía computarizada (MTC).[11] La presión de apertura del fluido en el canal espinal se obtiene realizando una punción lumbar, también conocida como punción espinal. Una vez que se ha medido la presión, se inyecta un agente de contraste radiológico en el LCR. Entonces, el contraste se difunde a través del saco dural y se escapa a través de los agujeros en la duramadre. Esto permite que se puedan localizar y obtener imágenes de los lugares donde la duramadre se ha roto utilizando un MTC con fluoroscopia observando el contraste que se encuentra fuera del saco dural en las imágenes.[10][19][20]
IRM editar
No está claro si las IRM deberían ser o no las herramientas de diagnóstico preferentes.[11][18][20] Las imágenes por resonancia magnética son menos efectivas que los TAC para obtener imágenes directas de los lugares en los que se produce la fuga de LCR. Los estudios de IRM podrían revelar la existencia de realce paquimeníngeo (cuando la duramadre tiene un aspecto grueso e inflamado), hundimiento del cerebro, agrandamiento de la hipófisis, higromas subdurales, obstrucción de los senos venosos craneales y otras anormalidades.[18] Los IRM dan resultados completamente normales para el 20% de los pacientes.[18] Los IRM que se realizan cuando el paciente está sentado de forma vertical (en contraposición a acostado en posición decúbito supino) no son mejores para diagnosticar fugas de LCR,[43] pero son el doble de efectivas para diagnosticar ectopia de las amígdalas cerebelosas, también conocida como malformación de Chiari.[44] Los síntomas de la ectopia de las amígdalas cerebelosas son muy similares a los de una fuga de LCR,[25] pero se origina o bien congénitamente o bien mediante un traumatismo, incluyendo mediante una lesión de latigazo cervical en la duramadre.[44]
También se puede utilizar una mielografía por resonancia magnética fuertemente ponderada hacia T2 como método alternativo para localizar el lugar donde se ha producido la fuga de LCR.[11] Este método ha sido efectivo para identificar el lugar en donde se ha producido la fuga de LCR sin necesidad de realizar un TAC ni punciones lumbares ni contrastes, y para localizar acumulaciones de líquido, como por ejemplo de LCR.[45] El contraste intratecal y la mielografía por resonancia magnética son otros métodos con una gran tasa de éxito para localizar una fuga de LCR.[11]
Ensayos químicos editar
Cuando se sospecha que existe una fuga de LCR craneal debido a la aparición de una secreción en la nariz o en la oreja que se sospecha que podría ser LCR, se puede recoger y analizar el fluido con un ensayo de β2-transferrina.[22] Esta prueba puede identificar con seguridad si el fluido es líquido cefalorraquídeo o no.[22]
Análisis del LCR editar
Se ha observado que los pacientes que tienen una fuga de LCR tienen presiones de apertura negativas o muy bajas durante la punción lumbar. Sin embargo, algunos pacientes en los que se ha confirmado que tienen una fuga de LCR también pueden manifestar una presión de apertura completamente normal. En entre el 18% y el 46% de los casos, la medida de la presión de LCR se encuentra dentro del rango normal.[11][46][47][48] Mediante el análisis del LCR se puede descubrir la presencia de pleocitosis linfocítica y de un elevado contenido en proteínas o xantocromía. Se cree que esto es debido a una permeabilidad de los vasos sanguíneos meníngeos dilatados mayor de lo normal y a un flujo de LCR menor de lo normal en el espacio subaracnoideo lumbar.[11]
Cuadro clínico editar
Los criterios de diagnóstico del síndrome de la fuga espontánea de LCR se basan en los criterios de la Clasificación Internacional de las Cefaleas de 2004, 2.ª edición (ICHD-II) (Tabla 1) (50). Sin embargo, el cuadro clínico de los pacientes que tengan un diagnóstico confirmado puede ser muy distinto al de los criterios clínicos de diagnóstico y, por tanto, no se considera que éstos sean fiables.[11]
Tratamiento editar
Entre las medidas iniciales que se pueden aplicar se encuentra el reposo, consumir cafeína (bebiendo café o mediante una infusión intravenosa) e hidratarse.[18] Los corticoides les podrían aliviar temporalmente los síntomas a algunos pacientes.[18] A algunas personas se les calman los síntomas de forma temporal al utilizar una faja abdominal, ya que ésta aumenta la presión intracraneal comprimiendo el abdomen.[49]
Parche hemático epidural editar
El tratamiento preferido para este problema es aplicar parches hemáticos epidurales quirúrgicamente,[14][50][51] lo cual tiene una tasa de éxito más alta que ciertos tratamientos más conservadores, como hidratarse y reposar en cama.[52] En un parche hemático epidural se utilizan los factores de coagulación de la sangre para coagular los lugares en los que hay agujeros, lo cual se consigue al inyectar la sangre del propio paciente en el área de la duramadre en la que se ha formado el agujero. El volumen de sangre autóloga y el número de intentos de aplicar un parche varían mucho dependiendo del paciente.[14] Entre un cuarto y un tercio de los pacientes con síndrome de la fuga espontánea de LCR no notan ninguna mejoría en sus síntomas tras recibir un parche hemático epidural.[11]
Sellador de pegamento de fibrina editar
Si los parches hemáticos no logran cerrar las rupturas en la duramadre por sí mismos, se puede utilizar pegamento de fibrina de forma percutánea en vez de los parches hemáticos, aumentando la efectividad de coagulación y de frenar la fuga de LCR.[2][11][11][53]
Técnica del drenaje quirúrgico editar
Cuando hay un caso extremo de una fuga de LCR difícil de tratar, se pueden utilizar drenajes lumbares quirúrgicos.[54][55][56] Se cree que este procedimiento disminuye el volumen de LCR espinal y aumenta el volumen y la presión intracraneal de LCR.[54] Este procedimiento restituye el volumen y la presión intracraneal de LCR hasta sus niveles normales y hace más fácil que las rupturas en la duramadre se curen, bajando la presión y el volumen en la misma.[54][56] Este procedimiento ha tenido buenos resultados, y ha producido el alivio de los síntomas durante hasta un año.[54][55]
Reparación neuroquirúrgica editar
Se puede aplicar neurocirugía para reparar directamente los divertículos meníngeos que tengan fugas en aquellos pacientes que no respondan ni a los parches hemáticos epidurales ni al pegamento de fibrina. Las áreas de la fuga en la duramadre se pueden unir mediante un proceso llamado ligadura y luego se puede poner un clip metálico para mantener la ligadura cerrada.[11] Otra opción sería colocar una pequeña compresa llamada gasa sobre la fuga en la duramadre, y sellarla con gelfoam y con pegamento de fibrina.[11] Las fugas de LCR casi nunca se pueden reparar mediante una sutura primaria, y en algunos pacientes puede ser necesario realizar una inspección de la duramadre para localizar correctamente todos los lugares a través de los cuales se escapa LCR.[11]
Pronóstico editar
Las consecuencias a largo plazo en las personas con síndrome de la fuga espontánea de LCR siguen estando mal estudiadas.[11] Los síntomas pueden desaparecer en tan sólo dos semanas o durar meses.[18] Aunque es menos común, hay pacientes que sufren durante muchos años de síntomas duraderos.[10][18][20][24] Algunas personas que tienen síndrome de la fuga espontánea de LCR de forma crónica están discapacitadas por ello y no pueden trabajar.[11][15] Es común que, después de una reparación reciente, aparezcan fugas recurrentes de LCR en un sitio distinto.[57]
Epidemiología editar
En un estudio realizado a nivel local en 1994 se calculó que 2 de cada 100.000 personas padecían el síndrome de la fuga espontánea de LCR, mientras que en un estudio realizado en salas de urgencias en 2004 se obtuvo un resultado de 5 de cada 100.000.[11][20] Las personas jóvenes y de mediana edad son las que tienen una mayor probabilidad de sufrir el síndrome de la fuga espontánea de LCR;[54] la edad media de aparición de la enfermedad es de 42,3 años, pero puede aparecer entre los 22 y los 61 años.[58] En un estudio realizado durante 11 años, se descubrió que las mujeres tenían el doble de probabilidades de contraer esta enfermedad en comparación con los hombres.[59][60]
Algunos estudios han probado que el síndrome de la fuga espontánea de LCR es hereditario. Se cree que el parecido genético entre los miembros de una familia es responsable de que se transmita una duramadre débil, lo cual produce el síndrome de la fuga espontánea de LCR.[11][61] Todavía no se han realizado estudios de poblaciones a gran escala.[20] A pesar de que la mayor parte de los casos de síndrome de la fuga espontánea de LCR todavía hoy no se diagnostican o se diagnostican de forma errónea, es improbable que se produzca un aumento real de la prevalencia de la enfermedad.[20]
Historia editar
Desde principios del siglo XX, varios médicos eminentes y en varias revistas médicas se han descrito casos de fugas de LCR espontáneas.[62][63] El neurólogo alemán Georg Schaltenbrand informó en 1938 y en 1953 sobre lo que él llamó "alicuorrea", una condición médica caracterizada por presiones de LCR o bien muy bajas, o bien imposibles de medir, o incluso negativas. Entre los síntomas se encuentran los dolores de cabeza ortostáticos y otras características que hoy se conocen como hipotensión intracraneal espontánea. Este síntoma ya se había descrito décadas atrás en bibliografía francesa como "hipotensión del fluido espinal" y como "colapso ventricular". En el año 1940, el neurólogo Henry Woltman de la Clínica Mayo escribió un artículo sobre "dolores de cabeza relacionados con la disminución de la presión intracraneal". Las manifestaciones clínicas completas de la hipotensión intracraneal y de las fugas de LCR se describieron en varias publicaciones entre la década de 1960 y principios de la década de 1990.[63] Los primeros informes modernos sobre casos de fugas de LCR espontáneas aparecieron en las revistas médicas a partir de finales de la década de 1980.[64]
Investigación editar
La tetracosactida es un corticosteroide que hace que el cerebro produzca líquido cefalorraquídeo extra para que se reponga el volumen perdido de LCR y que se alivien los síntomas, y se ha administrado con éxito por vía intravenosa para tratar las fugas de LCR.[65][66]
En tres estudios de pequeño tamaño de uno o de dos pacientes de fugas de LCR recurrentes, a los que se les aplicó parches hemáticos de forma repetida, pero no se logró la coagulación de los agujeros y el alivio los síntomas, se logró una recuperación completa de los síntomas (pero temporal) mediante una infusión salina epidural.[67][68] La infusión salina restaura de forma temporal el volumen necesario para evitar la hipotensión intracraneal espontánea hasta que se pueda reparar la fuga de forma adecuada.[11] En casos urgentes, como dolor imposible de tratar o disminución del nivel de consciencia, se utilizan infusiones salinas intratecales.[11]
El gen TGFBR2 está relacionado con varias enfermedades del tejido conectivo, entre las que se encuentran el síndrome de Marfan, la tortuosidad arterial y las aneurismas de la aorta torácica. Sin embargo, en un estudio realizado en pacientes con síndrome de la fuga espontánea de LCR se mostró que no se habían producido mutaciones en este gen.[11] El 20% de los pacientes con fugas de LCR han mostrado características menores del síndrome de Marfan. Se han encontrado niveles anormales de fibrilina 1 en estos pacientes de fugas de LCR, pero solo en un paciente había un nivel de fibrilina 1 consistente con el síndrome de Marfan.[11][69]
Referencias editar
- ↑ a b Lloyd, K. M.; Delgaudio, J. M.; Hudgins, P. A. (2008). «Imaging of Skull Base Cerebrospinal Fluid Leaks in Adults». Radiology 248 (3): 725-36. PMID 18710972. doi:10.1148/radiol.2483070362.
- ↑ a b c Gordon, N. (2009). «Spontaneous intracranial hypotension». Developmental Medicine & Child Neurology 51 (12): 932-935. PMID 19909307. doi:10.1111/j.1469-8749.2009.03514.x.
- ↑ Mokri, B. (2013). «Spontaneous low pressure, low CSF volume headaches: spontaneous CSF leaks». Headache: The Journal of Head and Face Pain 53 (7): 1034-1053. PMID 23808630. doi:10.1111/head.12149.
- ↑ Wise, S. K.; Schlosser, R. J. (2007). «Evaluation of spontaneous nasal cerebrospinal fluid leaks». Current Opinion in Otolaryngology & Head and Neck Surgery 15 (1): 28-34. PMID 17211180. doi:10.1097/MOO.0b013e328011bc76.
- ↑ Hayek, S. M.; Fattouh, M.; Dews, T.; Kapural, L.; Malak, O.; Mekhail, N. (2003). «Successful treatment of spontaneous cerebrospinal fluid leak headache with fluoroscopically guided epidural blood patch: a report of four cases». Pain Medicine 4 (4): 373-378. PMID 14750917. doi:10.1111/j.1526-4637.2003.03037.x.
- ↑ Maher, CO; Meyer; Mokri (2000). «Surgical treatment of spontaneous spinal cerebrospinal fluid leaks». Neurosurgical Focus 9 (1): e7. PMID 16859268. doi:10.3171/foc.2000.9.1.7.
- ↑ Greenberg, Mark (2006). Handbook of neurosurgery. Nueva York, NY: Thieme Medical Publishers. p. 178. ISBN 978-0-86577-909-9. Consultado el 18 de diciembre de 2009.
- ↑ Neil R. Miller; William Fletcher Hoyt (2005). Walsh and Hoyt's clinical neuro-ophthalmology. Lippincott Williams & Wilkins. pp. 1303-. ISBN 978-0-7817-4811-7. Consultado el 8 de noviembre de 2010.
- ↑ Mokri, B. (1999). «Spontaneous cerebrospinal fluid leaks: from intracranial hypotension to cerebrospinal fluid hypovolemia--evolution of a concept». Mayo Clinic Proceedings 74 (11): 1113-1123. PMID 10560599. doi:10.4065/74.11.1113.
- ↑ a b c d e f g h i j Schievink, WI (2000). «Spontaneous spinal cerebrospinal fluid leaks: a review». Neurosurgical Focus 9 (1): 1-9. PMID 16859269. doi:10.3171/foc.2000.9.1.8.
- ↑ a b c d e f g h i j k l m n ñ o p q r s t u v w x y z aa ab ac ad ae af Schievink, W. I. (2008). «Spontaneous spinal cerebrospinal fluid leaks». Cephalalgia : An International Journal of Headache 28 (12): 1345-1356. PMID 19037970. doi:10.1111/j.1468-2982.2008.01776.x.
- ↑ a b Vaidhyanath, R.; Kenningham, R.; Khan, A.; Messios, N. (2007). «Spontaneous intracranial hypotension: a cause of severe acute headache». Emergency Medicine Journal 24 (10): 739-741. PMC 2658456. PMID 17901290. doi:10.1136/emj.2007.048694.
- ↑ Schievink, W.; Palestrant, D.; Maya, M.; Rappard, G. (2009). «Spontaneous spinal cerebrospinal fluid leak as a cause of coma after craniotomy for clipping of an unruptured intracranial aneurysm». Journal of Neurosurgery 110 (3): 521-524. PMID 19012477. doi:10.3171/2008.9.JNS08670.
- ↑ a b c Mehta, B.; Tarshis, J. (2009). «Repeated large-volume epidural blood patches for the treatment of spontaneous intracranial hypotension». Canadian Journal of Anesthesia 56 (8): 609-13. PMID 19495908. doi:10.1007/s12630-009-9121-y.
- ↑ a b Mea, E.; Chiapparini, L.; Savoiardo, M.; Franzini, A.; Bussone, G.; Leone, M. (2009). «Clinical features and outcomes in spontaneous intracranial hypotension: a survey of 90 consecutive patients». Neurological Sciences 30 (S1): S11-S13. PMID 19415418. doi:10.1007/s10072-009-0060-8.
- ↑ a b c Victor, Maurice; Ropper, Allan H.; Adams, Raymond Delacy; Brown, Robert F. (2005). Adams and Victor's principles of neurology. Nueva York: McGraw-Hill Medical Pub. Division. pp. 541–543. ISBN 978-0-07-141620-7.
- ↑ Leep Hunderfund, A. N.; Mokri, B. (2011). «Second-half-of-the-day headache as a manifestation of spontaneous CSF leak». Journal of Neurology 259 (2): 306-10. PMID 21811806. doi:10.1007/s00415-011-6181-z.
- ↑ a b c d e f g h Spears, R. C. (2014). «Low-pressure/spinal fluid leak headache». Current Pain and Headache Reports 18 (6): 1-6. PMID 24760494. doi:10.1007/s11916-014-0425-4.
- ↑ a b Hofmann, E.; Behr, R.; Schwager, K. (2009). «Imaging of cerebrospinal fluid leaks». Klinische Neuroradiologie 19 (2): 111-121. PMID 19636501. doi:10.1007/s00062-009-9008-x.
- ↑ a b c d e f g h i Schievink, W. I. (2006). «Spontaneous Spinal Cerebrospinal Fluid Leaks and Intracranial Hypotension». Journal of the American Medical Association 295 (19): 2286-96. PMID 16705110. doi:10.1001/jama.295.19.2286.
- ↑ a b Mokri, B (2001). «Spontaneous intracranial hypotension». Current Pain and Headache Reports 5 (3): 284-91. PMID 11309218. doi:10.1007/s11916-001-0045-7.
- ↑ a b c d Abuabara, A (2007). «Cerebrospinal fluid rhinorrhoea: diagnosis and management». Medicina Oral, Patología Oral y Cirugía Bucal 12 (5): E397-400. PMID 17767107.
- ↑ Stenzel, M.; Preuss, S.; Orloff, L.; Jecker, P.; Mann, W. (2005). «Cerebrospinal Fluid Leaks of Temporal Bone Origin: Etiology and Management». ORL; Journal for Oto-Rhino-Laryngology and Its Related Specialties 67 (1): 51-5. PMID 15753623. doi:10.1159/000084306.
- ↑ a b c Schwedt, TJ; Dodick, DW (2007). «Spontaneous intracranial hypotension». Current Pain and Headache Reports 11 (1): 56-61. PMID 17214923. doi:10.1007/s11916-007-0023-9.
- ↑ a b «Spontaneous Spinal Cerebrospinal Fluid Leaks: Diagnosis».
- ↑ a b Schievink, W. I.; Maya, M. M. (2006). «Quadriplegia and cerebellar hemorrhage in spontaneous intracranial hypotension». Neurology 66 (11): 1777-8. PMID 16769965. doi:10.1212/01.wnl.0000218210.83855.40.
- ↑ Alonso Cánovas, A; Martínez San Millán, J; Novillo López, ME; Masjuán Vallejo, J (2008). «Third cranial nerve palsy due to intracranial hypotension syndrome». Neurología (Barcelona, España) 23 (7): 462-5. PMID 18726726.
- ↑ Sayao, AL; Heran, MK; Chapman, K; Redekop, G; Foti, D (2009). «Intracranial hypotension causing reversible frontotemporal dementia and coma». The Canadian Journal of Neurological Sciences 36 (2): 252-6. PMID 19378725. doi:10.1017/s0317167100006636.
- ↑ Ferrante, E.; Arpino, I.; Citterio, A.; Savino, A. (2009). «Coma resulting from spontaneous intracranial hypotension treated with the epidural blood patch in the Trendelenburg position pre-medicated with acetazolamide». Clinical Neurology and Neurosurgery 111 (8): 699-702. PMID 19577356. doi:10.1016/j.clineuro.2009.06.001.
- ↑ a b Woodworth, B. A.; Palmer, J. N. (2009). «Spontaneous cerebrospinal fluid leaks». Current Opinion in Otolaryngology & Head and Neck Surgery 17 (1): 59-65. PMID 19225307. doi:10.1097/MOO.0b013e3283200017.
- ↑ Schievink, W. I.; Moser, F. G.; Pikul, B. K. (2007). «Reversal of coma with an injection of glue». The Lancet 369 (9570): 1402. PMID 17448827. doi:10.1016/S0140-6736(07)60636-9.
- ↑ Schievink, W. I.; Louy, C. (2007). «Precipitating Factors of Spontaneous Spinal Csf Leaks and Intracranial Hypotension». Neurology 69 (7): 700-702. PMID 17698794. doi:10.1212/01.wnl.0000267324.68013.8e.
- ↑ a b Liu, F. -C.; Fuh, J. -L.; Wang, Y. -F.; Wang, S. -J. (2011). «Connective tissue disorders in patients with spontaneous intracranial hypotension». Cephalalgia 31 (6): 691-695. PMID 21220378. doi:10.1177/0333102410394676.
- ↑ Mokri, B. (2007). «Familial Occurrence of Spontaneous Spinal CSF Leaks: Underlying Connective Tissue Disorder (CME)». Headache: The Journal of Head and Face Pain 48 (1): 146-149. PMID 18184297. doi:10.1111/j.1526-4610.2007.00979.x.
- ↑ a b Franzini, A.; Messina, G.; Nazzi, V.; Mea, E.; Leone, M.; Chiapparini, L.; Broggi, G.; Bussone, G. (2009). «Spontaneous intracranial hypotension syndrome: a novel speculative physiopathological hypothesis and a novel patch method in a series of 28 consecutive patients». Journal of Neurosurgery 112 (2): 300-6. PMID 19591547. doi:10.3171/2009.6.JNS09415.
- ↑ Schlosser, RJ; Wilensky, EM; Grady, MS; Bolger, WE (2003). «Elevated intracranial pressures in spontaneous cerebrospinal fluid leaks». American Journal of Rhinology 17 (4): 191-5. PMID 12962187. doi:10.1177/194589240301700403.
- ↑ Schievink, WI; Jacques, L (2003). «Recurrent spontaneous spinal cerebrospinal fluid leak associated with "nude nerve root" syndrome: case report». Neurosurgery 53 (5): 1216-8; discussion 1218-9. PMID 14580290. doi:10.1227/01.NEU.0000089483.30857.11.
- ↑ Kim, K. T.; Kim, Y. B. (2010). «Spontaneous Intracranial Hypotension Secondary to Lumbar Disc Herniation». Journal of Korean Neurosurgical Society 47 (1): 48-50. PMC 2817515. PMID 20157378. doi:10.3340/jkns.2010.47.1.48.
- ↑ Michael Schuenke; Udo Schumacher; Erik Schulte; Edward D. Lamperti; Lawrence M. Ross (2007). Head and neuroanatomy. Thieme. ISBN 978-3-13-142101-2. Consultado el 8 de noviembre de 2010.
- ↑ Inamasu, J.; Guiot, B. (2006). «Intracranial hypotension with spinal pathology». The Spine Journal 6 (5): 591-9. PMID 16934734. doi:10.1016/j.spinee.2005.12.026.
- ↑ a b Schievink, W. I.; Maya, M. M.; Moser, F.; Tourje, J.; Torbati, S. (2007). «Frequency of spontaneous intracranial hypotension in the emergency department». The Journal of Headache and Pain 8 (6): 325-328. PMC 3476164. PMID 18071632. doi:10.1007/s10194-007-0421-8.
- ↑ Schievink, W. I. (2003). «Misdiagnosis of Spontaneous Intracranial Hypotension». Archives of Neurology 60 (12): 1713-8. PMID 14676045. doi:10.1001/archneur.60.12.1713.
- ↑ Schievink, W. I.; Tourje, J. (2007). «Upright MRI in Spontaneous Spinal Cerebrospinal Fluid Leaks and Intracranial Hypotension». Headache: The Journal of Head and Face Pain 47 (9): 1345-6. PMID 17927653. doi:10.1111/j.1526-4610.2007.00934.x.
- ↑ a b Freeman, MD; Rosa, S; Harshfield, D; Smith, F; Bennett, R; Centeno, C. J.; Kornel, E; Nystrom, A; Heffez, D; Kohles, S. S. (2010). «A case-control study of cerebellar tonsillar ectopia (Chiari) and head/neck trauma (whiplash)». Brain Injury 24 (7–8): 988-94. PMID 20545453. doi:10.3109/02699052.2010.490512.
- ↑ Wang, Y. -F.; Lirng, J. -F.; Fuh, J. -L.; Hseu, S. -S.; Wang, S. -J. (2009). «Heavily T2-weighted MR myelography vs CT myelography in spontaneous intracranial hypotension». Neurology 73 (22): 1892-8. PMID 19949036. doi:10.1212/WNL.0b013e3181c3fd99.
- ↑ Kelley, G (2004). «CSF hypovolemia vs intracranial hypotension in "spontaneous intracranial hypotension syndrome"». Neurology 62 (8): 1453. PMID 15111706. doi:10.1212/wnl.62.8.1453.
- ↑ Canas, N; Medeiros, E; Fonseca, AT; Palma-Mira, F (2004). «CSF volume loss in spontaneous intracranial hypotension». Neurology 63 (1): 186-7. PMID 15249640. doi:10.1212/01.wnl.0000132964.07982.cc.
- ↑ Mark S. Greenberg (2006). Handbook of neurosurgery. Thieme. pp. 178-. ISBN 978-3-13-110886-9. Consultado el 8 de noviembre de 2010.
- ↑ Schievink, W. I., & Deline, C. R. (2014). «Headache secondary to intracranial hypotension». Current Pain and Headache Reports 18 (457): 1-9. PMID 25255993. doi:10.1007/s11916-014-0457-9.
- ↑ Peng, PW; Farb (2008). «Spontaneous C1-2 CSF leak treated with high cervical epidural blood patch». The Canadian Journal of Neurological Sciences 35 (1): 102-5. PMID 18380287. doi:10.1017/s0317167100007654.
- ↑ Grimaldi, D.; Mea, E.; Chiapparini, L.; Ciceri, E.; Nappini, S.; Savoiardo, M.; Castelli, M.; Cortelli, P.; Carriero, M. R.; Leone, M.; Bussone, G. (2004). «Spontaneous low cerebrospinal pressure: a mini review». Neurological Sciences 25 (S3): S135-S137. PMID 15549523. doi:10.1007/s10072-004-0272-x.
- ↑ Wang, S.; Lirng, J.; Hseu, S.; Chan, K. (2008). «Spontaneous Intracranial Hypotension Treated by Epidural Blood Patches». Acta Anaesthesiologica Taiwanica 46 (3): 129-133. PMID 18809524. doi:10.1016/S1875-4597(08)60007-7.
- ↑ Schievink, W. I.; Maya, M. M.; Moser, F. M. (2004). «Treatment of spontaneous intracranial hypotension with percutaneous placement of a fibrin sealant». Journal of Neurosurgery 100 (6): 1098-1100. PMID 15200130. doi:10.3171/jns.2004.100.6.1098.
- ↑ a b c d e Schievink, W. I. (2009). «A Novel Technique for Treatment of Intractable Spontaneous Intracranial Hypotension: Lumbar Dural Reduction Surgery». Headache: The Journal of Head and Face Pain 49 (7): 1047-1051. PMID 19473279. doi:10.1111/j.1526-4610.2009.01450.x.
- ↑ a b Kitchel, SH; Eismont, FJ; Green, BA (1989). «Closed subarachnoid drainage for management of cerebrospinal fluid leakage after an operation on the spine». The Journal of Bone and Joint Surgery. American Volume 71 (7): 984-7. PMID 2760094. doi:10.2106/00004623-198971070-00004.
- ↑ a b Roosendaal, C. M.; Coppes, M. H.; Vroomen, P. C. A. J. (2009). «The paradox of intracranial hypotension responding well to CSF drainage». European Journal of Neurology 16 (12): e178-9. PMID 19863649. doi:10.1111/j.1468-1331.2009.02803.x.
- ↑ Schievink, W. I.; Maya, M. M.; Riedinger, M. (2003). «Recurrent spontaneous spinal cerebrospinal fluid leaks and intracranial hypotension: a prospective study». Journal of Neurosurgery 99 (5): 840-842. PMID 14609162. doi:10.3171/jns.2003.99.5.0840.
- ↑ Schievink, W. I.; Morreale, V. M.; Atkinson, J. L. D.; Meyer, F. B.; Piepgras, D. G.; Ebersold, M. J. (1998). «Surgical treatment of spontaneous spinal cerebrospinal fluid leaks». Journal of Neurosurgery 88 (2): 243-246. PMID 9452231. doi:10.3171/jns.1998.88.2.0243.
- ↑ Ferrante, E.; Wetzl, R.; Savino, A.; Citterio, A.; Protti, A. (2004). «Spontaneous cerebrospinal fluid leak syndrome: report of 18 cases». Neurological Sciences. 25. Suppl 3 (S3): S293-S295. PMID 15549566. doi:10.1007/s10072-004-0315-3.
- ↑ Schievink, W.; Maya, M.; Pikul, B.; Louy, C. (2009). «Spontaneous spinal cerebrospinal fluid leaks as the cause of subdural hematomas in elderly patients on anticoagulation». Journal of Neurosurgery 112 (2): 295-299. PMID 19199465. doi:10.3171/2008.10.JNS08428.
- ↑ Larrosa, D; Vázquez, J; Mateo, I; Infante, J (2009). «Síndrome de hipotensión intracraneal espontánea de presentación familiar». Neurología (Barcelona, España) 24 (7): 485-7. PMID 19921558.
- ↑ Schaltenbrand, G (1953). «Normal and pathological physiology of the cerebrospinal fluid circulation». Lancet 1 (6765): 805-8. PMID 13036182. doi:10.1016/S0140-6736(53)91948-5.
- ↑ a b Mokri, B (2000). «Cerebrospinal fluid volume depletion and its emerging clinical/imaging syndromes». Neurosurgical Focus 9 (1): 1-7. PMID 16859267. doi:10.3171/foc.2000.9.1.6.
- ↑ Rupp, S. M.; Wilson, C. B. (1989). «Treatment of spontaneous cerebrospinal fluid leak with epidural blood patch». Journal of Neurosurgery 70 (5): 808-10. PMID 2709124. doi:10.3171/jns.1989.70.5.0808.
- ↑ Carter, B.; Pasupuleti, R. (2000). «Use of intravenous cosyntropin in the treatment of postdural puncture headache». Anesthesiology 92 (1): 272-274. PMID 10638928. doi:10.1097/00000542-200001000-00043.
- ↑ Cánovas, L; Barros, C; Gómez, A; Castro, M; Castro, A (2002). «Use of intravenous tetracosactin in the treatment of postdural puncture headache: our experience in forty cases». Anesthesia and Analgesia 94 (5): 1369. PMID 11973227. doi:10.1097/00000539-200205000-00069.
- ↑ Rouaud, T.; Lallement, F.; Choui, R.; Madigand, M. (2009). «Traitement de l'hypotension spontanée du liquide cérébrospinal par perfusion épidurale de sérum salé isotonique». Revue Neurologique 165 (2): 201-5. PMID 19010507. doi:10.1016/j.neurol.2008.05.006.
- ↑ Binder, DK; Dillon, WP; Fishman, RA; Schmidt, MH (2002). «Intrathecal saline infusion in the treatment of obtundation associated with spontaneous intracranial hypotension: technical case report». Neurosurgery 51 (3): 830-6; discussion 836-7. PMID 12188967. doi:10.1097/00006123-200209000-00045.
- ↑ Schrijver, I.; Schievink, W. I.; Godfrey, M.; Meyer, F. B.; Francke, U. (2002). «Spontaneous spinal cerebrospinal fluid leaks and minor skeletal features of Marfan syndrome: a microfibrillopathy». Journal of Neurosurgery 96 (3): 483-9. PMID 11883832. doi:10.3171/jns.2002.96.3.0483.