Punto triple
El punto triple es aquel en el cual coexisten en equilibrio el estado sólido, el estado líquido y el estado gaseoso de una sustancia. Se define con respecto a una temperatura y una presión de vapor.

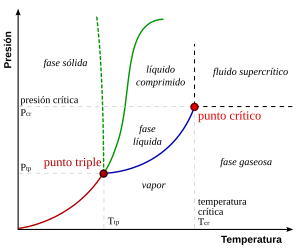
El punto triple del agua, por ejemplo, está a 273,16 K (0,01 °C) y a una presión de 611,73 Pa ITS90. Esta temperatura, debido a que es un valor constante, sirve para calibrar las escalas Kelvin y Celsius de los termómetros de mayor precisión.
Punto triple del agua editar
Es la combinación de presión y temperatura en la que los estados de agregación del agua, sólido, líquido y gaseoso (hielo, agua líquida y vapor, respectivamente) pueden coexistir en un equilibrio estable. Se produce exactamente a una temperatura de 273,16 K (0,0098 °C) y a una presión parcial de vapor de agua de 611,73 pascales (6,1173 milibares; 0,0060373057 atm). En esas condiciones, es posible cambiar el estado de toda la masa de agua a hielo, agua líquida o vapor, arbitrariamente, haciendo pequeños cambios en la presión y la temperatura. Se debe tener en cuenta que incluso si la presión total de un sistema está muy por encima de 611,73 pascales (es decir, un sistema con una presión atmosférica normal), si la presión parcial del vapor de agua es 611,73 pascales, entonces el sistema puede encontrarse aún en el punto triple del agua. Estrictamente hablando, las superficies que separan las distintas fases también debe ser perfectamente planas, para evitar los efectos de las tensiones de superficie.
El agua tiene un inusual y complejo diagrama de fase (aunque esto no afecta a las consideraciones generales expuestas sobre el punto triple). A altas temperaturas, incrementando la presión, primero se obtiene agua líquida y, a continuación, agua sólida. Por encima de 109 Pa aproximadamente se obtiene una forma cristalina de hielo. A temperaturas más bajas en virtud de la compresión, el estado líquido deja de aparecer y el agua pasa directamente de sólido a gas.
A presiones constantes por encima del punto triple, calentar hielo hace que se pase de sólido a líquido y de este a gas (o vapor). A presiones por debajo del punto triple, como las encontradas en el espacio exterior, donde la presión es cercana a cero, el agua líquida no puede existir y, al calentarse, el hielo se convierte directamente en vapor de agua sin pasar por el estado líquido, proceso conocido como sublimación.
La presión del punto triple del agua fue utilizada durante la misión Mariner 9 a Marte como un punto de referencia para definir "el nivel del mar". Misiones más recientes hacen uso de altimetría láser y gravimetría en lugar de la presión atmosférica para medir la elevación en Marte.
Se deben tener en consideración los grados de libertad que nos permite apreciar con mayor facilidad las variables de presión y temperatura, en que momento se pueden modificar y esta dada por la siguiente ecuación:
L=C-F+2
Donde
L=Grados de libertad(variables que puedes modificar).
C=Número de componentes del sistema.
F= Número de fases del sistema.
Tabla pertinente para conocer los grados de libertad sobre un diagrama de fases.[1]
| Ubicación | Fases | Grados de libertad | Significado |
|---|---|---|---|
| Área | 1 | 2 | Se pueden mover 2 variables |
| Sobre línea | 2 | 1 | Se puede mover una variable |
| Punto triple | 3 | 0 | No se puede mover ninguna variable |
Tabla de puntos triples editar
En esta tabla se incluyen los puntos triples de algunas sustancias comunes. Estos datos están basados en los proporcionados por la National Bureau of Standards (ahora NIST) de los EE. UU de América.[2]
| Sustancia | T(K) | P (kPa) |
|---|---|---|
| Acetileno | 192,4 | 120 |
| Amoniaco | 195,40 | 6,076 |
| Argón | 83,81 | 68,9 |
| Grafito | 3900 | 10100 |
| Dióxido de carbono | 216,55 | 517 |
| Monóxido de carbono | 68,10 | 15,37 |
| Deuterio | 18,63 | 17,1 |
| Etano | 89,89 | 8 × 10−4 |
| Etileno | 104,0 | 0,12 |
| Helio-4 | 2,19 | 5,1 |
| Hidrógeno | 13,84 | 7,04 |
| Cloruro de hidrógeno | 158,96 | 13,9 |
| Mercurio | 234,2 | 1,65 × 10−7 |
| Metano | 90,68 | 11,7 |
| Neón | 24,57 | 43,2 |
| Óxido nítrico | 109,50 | 21,92 |
| Nitrógeno | 63,18 | 12,6 |
| Óxido nitroso | 182,34 | 87,85 |
| Oxígeno | 54,36 | 0,152 |
| Paladio | 1825 | 3,5 × 10−3 |
| Platino | 2045 | 2,0 × 10−4 |
| Dióxido de azufre | 197,69 | 1,67 |
| Titanio | 1941 | 5,3 × 10−3 |
| Hexafluoruro de uranio | 337,17 | 151,7 |
| Agua | 273,16 | 0,61 |
| Xenón | 161,3 | 81,5 |
| Zinc | 692,65 | 0,065 |
Región del punto triple editar
El punto triple, como se ha descrito, es un punto del diagrama p - T, de modo que la presión y la temperatura de un sistema situado en el punto triple se determinan de forma única. Sin embargo, cuando el sistema se encuentra en este punto, puede asumir diferentes estados de equilibrio, siempre que ninguna de las fases desaparezca por completo. El sistema puede, por ejemplo, intercambiar calor con el entorno y su volumen puede cambiar; en el proceso, las proporciones relativas de las tres fases cambian. Las coordenadas extensas de energía interna y volumen total son útiles como coordenadas de estado. En el diagrama U-V, los estados de coexistencia simultánea de las tres fases llenan una región bidimensional, mientras que la presión y la temperatura están aquí degeneradas a un valor constante.[3] Aparte de su reconocibilidad, es precisamente esta insensibilidad a las pequeñas variaciones de volumen y de entrada y salida de calor lo que distingue al punto triple para su uso como referencia de temperatura.
En una representación de los estados de equilibrio como una superficie en un espacio de presión - volumen - temperatura, véase el diagrama, el área triple se reduce a una línea unidimensional, la línea triple, que se caracteriza por los valores constantes del punto triple para la presión y la temperatura. A lo largo de la línea triple, los diferentes valores de volumen corresponden a cambios en las fracciones de volumen de las fases.
La variabilidad de la cantidades extensivas el volumen y la energía interna no contradice la regla de fase de Gibbs, ya que esta regla solo hace afirmaciones sobre variables intensiva.
Celdas de punto triple editar
Las celdas de punto triple se utilizan en la calibración de los termómetros. Para un trabajo exacto, las celdas de punto triple suelen llenarse con una sustancia química de gran pureza, como el hidrógeno, el argón, el mercurio o el agua (dependiendo de la temperatura deseada). La pureza de estas sustancias puede ser tal que solo una parte en un millón sea contaminante, lo que se denomina "seis nueves" porque tiene una pureza del 99,9999%. Se utiliza una composición isotópica específica (para el agua, VSMOW) porque las variaciones en la composición isotópica provocan pequeños cambios en el punto triple. Las celdas de punto triple son tan eficaces para lograr temperaturas altamente precisas y reproducibles, que un estándar de calibración internacional para termómetros llamado ITS-90 se basa en celdas de punto triple de hidrógeno, neón, oxígeno, argón, mercurio, y agua para delinear seis de sus puntos de temperatura definidos.
Estados superiores sin grados de libertad editar
Como muestra la regla de las fases, un estado de un sistema monocomponente en el que existen tres fases en equilibrio no tiene ningún grado de libertad restante (es un estado "invariante" o "no variante"), y en dicho sistema no pueden coexistir más de tres fases. Sin embargo, de la regla de las fases también se deduce que en los sistemas formados por varios componentes independientes pueden existir más de tres fases en equilibrio en puntos invariantes.
Punto cuádruple editar
Si un sistema formado por dos componentes independientes puede descomponerse en cuatro fases diferentes, entonces un estado en el que las cuatro fases están en equilibrio es un estado invariante.[4] Un ejemplol[5] para un punto cuádruple de este tipo es el punto eutéctico de un sistema binario con equilibrio de
- dos fases sólidas,
- una fase líquida y
- una fase gaseosa.
Punto quíntuple editar
Si un sistema formado por tres componentes independientes puede descomponerse en cinco fases diferentes, entonces un estado en el que las cinco fases están en equilibrio es un estado invariante.[6] Un ejemplo[6] es un sistema, de los siguientes tres componentes
- agua, H2O
- sulfato de sodio, Na2SO4
- sulfato de magnesio, MgSO4
existe. A una temperatura de 22 °C, pueden coexistir las siguientes cinco fases:
- vapor de agua
- una mezcla líquida de agua, sulfato de magnesio y sulfato de sodio
- cristales de sulfato de sodio -decahidrato, Na2SO4 · 10 H2O
- cristales de sulfato de magnesio decahidratado, MgSO4 · 10 H2O
- cristales de sulfato de sodio y magnesio tetrahidratado, Na2Mg[SO4]2 · 4 H2O
Caso especial del helio editar
La única sustancia conocida que no tiene un punto triple sólido-líquido-gas es el helio. Tiene un punto triple (ver también punto lambda) donde coexisten helio líquido I, helio superfluido II y helio gaseoso (2,1768 K/5,0418 kPa), así como un punto triple donde está helio líquido I, helio superfluido II y helio sólido. equilibrio (aprox. 1,5 K/2,5 MPa).[7][8]
Véase también editar
Referencias editar
- ↑ El numero efectivo de grados de libertad.Enrique Villa Diharce.2004
- ↑ Yunus A. Cengel, Robert H. Turner. Fundamentals of thermal-fluid sciences. McGraw-Hill, 2004, p. 78. ISBN 0-07-297675-6
- ↑ Elliott H. Lieb, Jakob Yngvason (1999). III Simple Systems, A Coordinates of simple systems. «The Physics and Mathematics of the Second Law of Thermodynamics». Physics Reports , 310, 1: 37 u. 101. arXiv:cond-mat/9708200. doi:10.1016/S0370-1573(98)00082-9.
- ↑ P. Duhem: Thermodynamics and Chemistry. (G.K. Burgess transl.). John Wiley & Sons, New York 1903, pag. 192
- ↑ Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 1151.
- ↑ a b P. Duhem: Thermodynamics and Chemistry. (G.K. Burgess transl.). John Wiley & Sons, New York 1903, pag. 193
- ↑ A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 1. Band: Grundlagen und Hauptgruppenelemente. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049585-0, pag. 462
- ↑ NIST technical note 1334: Thermophysical Properties of Helium-4 From 0.8 to 1500 K With Pressures to 2000 MPa