Talidomida
La talidomida es un fármaco desarrollado por la compañía farmacéutica alemana Grünenthal GmbH y comercializado de 1957 a 1963 como sedante y como calmante de las náuseas durante los tres primeros meses de embarazo (hiperémesis gravídica), que provocó miles de casos de malformaciones congénitas.[cita requerida]
| Talidomida | ||
|---|---|---|
 | ||
 | ||
| Nombre (IUPAC) sistemático | ||
| (RS)-2-(2,6-dioxopiperidin-3-il)isoindol-1,3-diona | ||
| Identificadores | ||
| Número CAS | 50-35-1 | |
| Código ATC | L04AX02 | |
| PubChem | 5426 | |
| DrugBank | APRD01251 | |
| ChemSpider | 5233 | |
| Datos químicos | ||
| Fórmula | C13H10N2O4 | |
| Peso mol. | 258.23 g/mol | |
| Farmacocinética | ||
| Unión proteica | 55% y 66% para la (+)-R y (–)-S enantiómeros, respectivamente | |
| Vida media | Rangos medios de aproximadamente 5 a 7 h con una sola dosis; no se altera con dosis múltiples | |
| Datos clínicos | ||
| Cat. embarazo | X (AU) X. Restricción total del uso del fármaco. Los riesgos superan los beneficios potenciales (EUA) | |
| Estado legal | Retirada | |
Como sedante tuvo un gran éxito popular ya que, en un principio, se creyó que no causaba casi ningún efecto secundario y, en caso de ingestión masiva, no resultaba letal[cita requerida]. Este medicamento, producido por Grünenthal GmbH en Alemania, provocó miles de nacimientos de bebés afectados de focomelia, anomalía congénita que se caracterizaba por la carencia o excesiva cortedad de las extremidades.[cita requerida]
La talidomida afectaba a los fetos de dos maneras: bien que la madre tomara el medicamento directamente como sedante o calmante de náuseas o bien que fuera el padre quien lo tomase, ya que la talidomida afectaba al esperma transmitiendo los efectos nocivos desde el momento de la concepción[cita requerida]. Una vez comprobados los efectos teratogénicos nocivos del medicamento (que provocaban malformaciones congénitas) descubiertos inicialmente por el doctor Widukind Lenz[1] y su compañero de la Clínica Universitaria de Hamburgo, el español Claus Knapp,[2] este fue retirado en los países donde había sido comercializado bajo diferentes nombres. España fue de los últimos, pues lo retiró en 1963.[3]
Investigando se descubrió que había dos talidomidas distintas, aunque de igual fórmula molecular, en las cuales cambiaba la disposición de los grupos en un carbono, cosa que hasta entonces no se tenía en cuenta. Se trataba, por tanto, de una sola molécula con dos enantiómeros. Están pues (según la nomenclatura actual) la forma R (que producía el efecto sedante que se buscaba) y la S que producía efectos teratogénicos y la que causaba amelia. Este descubrimiento produjo que a partir de ese momento se tuviese en cuenta la estereoisomería en moléculas, utilizando el sistema R/S actual.
La talidomida se comercializó con estos nombres (entre otros): Imidan, Varian, Contergan, Gluto Naftil, Softenon, Noctosediv, Entero-sediv, Entero-Sediv-Suspenso…
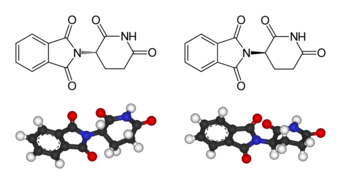
Izq.: (S)-talidomida
Der.: (R)-talidomida
El impacto social de la talidomida editar
El fármaco provocó la denominada "catástrofe de la talidomida", ya que miles de bebés nacieron en todo el mundo con severas malformaciones irreversibles. Muchos de estos individuos tuvieron (y tienen) dificultades en integrarse en la sociedad a causa de su limitación física. De hecho, nunca se hubiera sabido su teratogenicidad si la malformación que hubiese provocado fuera más común, como por ejemplo problemas cardíacos, ya que las dismelias que provoca son bastante raras.
Además, la alarma social que provocaron los severos efectos secundarios hizo que los responsables de Sanidad de muchos países empezaran a hacer un control estricto de los medicamentos antes de su comercialización. Por ejemplo, en Alemania, uno de los países más afectados por la talidomida (bajo el nombre de Contergan), antes de la catástrofe no existía ninguna ley ni comisión de control de medicamentos. En efecto, después de la catástrofe, muchos países paulatinamente empezaron a promulgar leyes de control de los medicamentos y también la exigencia que éstos sean sometidos a ensayos farmacológicos y probados en animales, además de ensayos clínicos en personas antes de su comercialización.
En Estados Unidos, la doctora Frances Oldham Kelsey, revisora de la FDA, se negó a autorizar el medicamento y pidió más estudios,[4] aun cuando había sido aprobado en más de 20 países europeos y africanos.[5] Su insistencia en que el medicamento debía ser completamente analizado antes de su aprobación fue dramáticamente justificada cuando sobrevino la catástrofe.[6] Como resultado, las reformas a las pruebas clínicas de medicamentos fueron aprobadas por unanimidad por el Congreso en 1962.[6] Estas reformas requerían "límites más estrictos para las pruebas y la distribución de nuevos medicamentos",[7] para evitar problemas similares. La enmienda reconoció también, por vez primera, que "la eficacia debería ser establecida antes de su comercialización".[6]
Otros efectos secundarios diferentes a los teratogénicos editar
Después de la reaparición de este medicamento es necesario saber que son comunes la cefalea, náuseas, somnolencia, mareo, xerostomía y onicolisis; todos desaparecen al suspender su consumo. [cita requerida]
La talidomida hoy en día editar
En la actualidad, la talidomida se vuelve a utilizar, con el apoyo de la OMS, en algunos países, porque se ha comprobado su eficacia en enfermedades como la lepra. Se conocen casos de nacimientos de niños con dismelia en Etiopía y Brasil, hijos de padres tratados con talidomida.
Se puede encontrar en venta en Internet, pero este tipo de venta es totalmente fraudulenta.
También se están realizando ensayos con talidomida y algunos de sus derivados en enfermos que padecen ciertos tipos de cáncer. Se ha comprobado su eficacia en casos de mieloma múltiple, aplicándose especialmente en casos en los que los tratamientos convencionales (quimio y radioterapia) no han tenido éxito o no son viables. En algunos casos la talidomida ha superado en eficiencia a la terapia convencional.[8]
Mecanismos de acción editar
El uso de la talidomida se hace bajo estricta supervisión médica. Su efecto inmunomodulador y antiinflamatorio se explica mediante la inducción en el incremento de la relación linfocitos T CD8/CD4 por disminución de los linfocitos T colaboradores circulantes, además inhibe la producción de Interleucina 1 y 12, los factores de necrosis tumoral alfa.[9]
Usos médicos actuales editar
Se ha usado con éxito y como terapia alternativa o de segunda elección para enfermedades como: lupus eritematoso discoide, enfermedad de Behcet, eritema nodoso, tratamiento complementario paliativo para tuberculosis, cuando surge resistencia múltiple a los medicamentos de base (isoniacida y rifampicina), lepra, enfermedad injerto contra huésped, úlceras aftosas en pacientes con VIH, estomatitis aftosa recurrente, prúrigo nodular, prúrigo actínico y mieloma múltiple.[10] Actualmente se están desarrollando estudios con la droga en casos de prostatitis crónica. [cita requerida]
Dosis y presentación editar
Viene en tabletas de 50 mg y se administran en dosis de 200 a 1200 mg diarios. En el tratamiento de mieloma múltiple la dosis se incrementan en 200 mg/día cada dos semanas hasta que aparezcan los efectos secundarios de la dosis (sedación, fatiga, estreñimiento, neuropatía sensorial) También se administraban en jarabes, había que tomar de 10 a 20 mg según el grado de náuseas.
Véase también editar
Referencias editar
- ↑ «Talidomida» (en españa). 2012. Archivado desde el original el 14 de julio de 2018. Consultado el 18 de octubre de 2013.
- ↑ «El detective de la talidomida». El País.
- ↑ «Los hijos de la talidomida en Galicia siguen esperando una compensación» Archivado el 13 de agosto de 2014 en Wayback Machine.. El Correo Gallego.
- ↑ «Frances Kelsey». Canada Heirloom Series (en inglés). Heirloom Publishing Inc. 1986. Consultado el 2 de abril de 2010.
- ↑ *Rouhi, Maureen (20 de junio de 2005). «Top Pharmaceuticals: Thalidomide». Chemical & Engineering News (en inglés) (American Chemical Society) 83 (25). Consultado el 2 de abril de 2010.
- ↑ a b c «The Story Of The Laws Behind The Labels». FDA Consumer (en inglés). junio de 1981. Consultado el 2 de abril de 2010.
- ↑ Simpson, Joanne Cavanaugh (septiembre de 2001). «Pregnant Pause». Johns Hopkins Magazine (en inglés) 53 (4). Consultado el 2 de abril de 2010.
- ↑ Iriberri, Ainhoa (2008). «Cara y cruz de un fármaco maldito». Madrid, España: Mediapubli Sociedad de Publicaciones y Ediciones S.L. Archivado desde el original el 1 de febrero de 2008. Consultado el 29 de enero de 2008.
- ↑ Dermatologia En Medicina General / Dermatology in General Medicine, pág 2234, en Google libros
- ↑ «Talidomida (Thalomid®)-Información útil para los pacientes y sus familiares». Grupo Español de Pacientes con Cáncer (GEPAC).
Bibliografía editar
- Gamero Esparza, Carlos., Píldoras en su laberinto Revista Vivat Academia. Noviembre de 2002, Nº 40. Publicado en el sitio: http://www2.uah.es/vivatacademia/anteriores/n40/ambiente.htm Archivado el 4 de abril de 2017 en Wayback Machine.
- Gamero Esparza, Carlos., Cifras de la Talidomida Publicado en el sitio: https://web.archive.org/web/20090203053857/http://www.avite.org/cifras2.htm
- Isaza M., et al. Fundamentos de farmacología en terapéutica. Colombia: 4.ª ed; 2002.
- Jara, Miguel (2007). «Holocausto Talidomida (El Regreso)». Traficantes de salud: cómo nos venden medicamentos peligrosos y juegan con la enfermedad. Barcelona: Icaria Editorial. ISBN 84-7426-913-X.