Varidnaviria
Varidnaviria es un dominio de virus de ADN establecido por el ICTV que incluye los virus que se caracterizan por tener una proteína en rollo de gelatina vertical dentro la cápside, que puede ser en doble rollo (DJR-MCP) o en simple rollo (SJR-MCP). En este dominio se incluye a los virus gigantes, los virófagos, los adenovirus y varias familias de virus procariotas. El dominio contiene dos reinos y tres filos.[1] La proteína específica de este dominio es similar a una proteína celular llamada nucleoplasmina.[2]
| Varidnaviria | ||
|---|---|---|
 | ||
| Taxonomía | ||
| Dominio: | Varidnaviria | |
| Clasificación de Baltimore | ||
| Reinos | ||
Los genomas de casi todos sus miembros son de ADN bicatenario, aunque una de sus familias Finnlakeviridae tiene un genoma de ADN monocatenario pero evolucionaron de virus de ADN bicatenario de este dominio.[3]
Historia editar
Las enfermedades causadas por poxvirus se conocen desde hace gran parte de la historia. La viruela, en particular, ha sido muy importante en la medicina moderna; la primera vacuna que se inventó fue dirigida contra la viruela, y se convertiría más tarde en la primera enfermedad en ser erradicada.[4] Los adenovirus humanos fueron los primeros virus DJR-MCP de este dominio en analizarse sus MCP, destacándose por tener pliegues en forma de gelatina que eran perpendiculares, en lugar de paralelos, a la superficie de la cápside. En 1999, se resolvió la estructura de la MCP del bacteriófago PRD1 de Pseudomonas, mostrando que el linaje DJR-MCP incluía virus procariotas. El virus SH1 de la arquea Haloarcula se convertiría más tarde, en 2003, en el primer SJR-MCP descubierto.[1]
Con el tiempo, el uso de la metagenómica ha permitido la identificación de virus en el medio ambiente incluso sin la identificación del huésped o de las muestras de laboratorio, lo que ha llevado al descubrimiento de muchos miembros adicionales del dominio. Los estudios morfológicos de muestras marinas sugieren que los virus procariotas sin cola pueden ser más numerosos que los virus procariotas con cola.[1]
Características editar
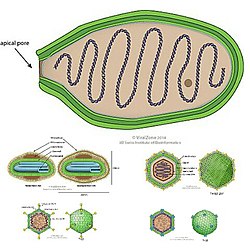
La mayoría de los virus de Varidnaviria contienen una cápside que está hecha de las principales proteínas de la cápside que contienen pliegues verticales simples (SJR) o en doble rollo vertical de gelatina (DJR). Las principales proteínas de la cápside se denominan así porque son las proteínas primarias de las que está hecha la cápside. Un pliegue en rollo de gelatina es un tipo de estructura plegada en una proteína en la que ocho hebras beta antiparalelas se organizan en cuatro hojas beta antiparalelas en un diseño que se asemeja a un rollo de gelatina, también llamado rollo suizo. Cada hebra beta es una secuencia específica de aminoácidos y estas hebras se unen a sus hebras antiparalelas mediante enlaces de hidrógeno. La diferencia entre los pliegues SJR y DJR es que un pliegue DJR es simplemente dos pliegues SJR en una sola proteína. Los pliegues verticales son aquellos que son perpendiculares a la superficie de la cápside, en contraste con los pliegues horizontales que son paralelos a la superficie de la cápside.[1][5][6][7]
Durante el proceso de ensamblaje de la cápside viral, los MCP se autoensamblan en estructuras hexagonales, llamadas hexones que contienen múltiples copias del MCP. Luego, los hexones se unen para formar los lados triangulares relativamente planos de la cápside icosaédrica. Todos los virus de Varidnaviria que codifican un DJR-MCP que se han analizado en alta resolución también codifican una proteína de la cápside menor (mCP) que contiene un pliegue SJR. Estos mCP se ensamblan en estructuras pentagonales llamadas pentones que forman los vértices pentagonales de la cápside icosaédrica.[1][5][6][7]
La mayoría de los miembros del dominio también codifican ATPasas de empaquetamiento del genoma de la superfamilia FtsK-HerA. Las ATPasas en Varidnaviria son enzimas que empaquetan el ADN viral en la cápside durante el proceso de ensamblaje de viriones. FtsK es una familia de proteínas que contiene una proteína transmembrana con cuatro hélices que atraviesan la membrana al comienzo de la secuencia de aminoácidos de la proteína y una ATPasa con un pliegue del bucle P al final de la secuencia de aminoácidos de la proteína y la familia HerA es homóloga a FtsK. La función exacta de la ATPasa para algunos virus en Varidnaviria no está clara ya que las características morfológicas, como el genoma circular superenrollado del bacteriófago PM2 de Pseudoalteromonas aparentemente prohíbe la translocación por la ATPasa del ADN desde el exterior de la cápside hacia el interior. El subconjunto de la superfamilia FtsK-HerA que se encuentra en Varidnaviria a menudo se denomina clado A32, llamado así por el gen A32 (R) que codifica ATPasa del virus Vaccinia.[1][5][6][7]
Otras características que son comunes o únicas en linajes de Varidnaviria son:[1][5][6][7][8]
- Todos conservan genes únicos que se remontan al último ancestro común.
- Casi todos los miembros del dominio codifican una ATPasa de la superfamilia FtsK-HerA. Los adenovirus son la excepción, en cambio codifican su propia ATPasa distinta que tiene el mismo papel que la ATPasa de FtsK-HerA.
- Los virus DJR-MCP también codifican una proteína SJR-MCP menor como componente secundario igual que los virus SJR-MCP.
- Todos los miembros del dominio codifican una ADN polimerasa de tipo B, que copia el ADN viral y, a menudo, componentes adicionales de la ADN polimerasa, como las helicasas de la superfamilia 3 o proteínas de iniciación de replicación, en el caso de la familia Corticoviridae.
- Casi todos los miembros de Varidnaviria tienen genomas de ADN bicatenario. Con excepción de Finnlakeviridae que tiene un genoma de ADN monocatenario.
- En la mayoría de los virus, el genoma dentro de la cápside está rodeado por una envoltura vírica.
- La mayoría de los miembros del dominio tienen cápsides icosaedricas, que contienen 20 caras triangulares y 12 vértices. Aunque en algunas familias de virus gigantes y la clase propuesta Naldaviricetes la forma icosaédrica ancestral se ha perdido y se ha reemplazado por formas inusuales, como ovoides o varas.
- Los virus con formas inusuales codifican una proteína de andamio, que guía la construcción geométrica de la cápside viral, que también se pliega en pseudohexámeros DJR-MCP.
- Algunos miembros del dominio codifican una integrasa, una enzima que integra el ADN viral en el genoma del huésped.
- Muchos virus DJR-MCP codifican una proteasa de maduración de la cápside que participa en el ensamblaje de la cápside.
- Algunos virus tienen vértices especiales en sus cápsides icosaédricas para transportar el genoma fuera de la cápside y para hacer fábricas de virus.
Muchos virus de Varidnaviria codifican la enzima integrasa, lo que les permite integrar su ADN en el huésped y que este pueda comportarse como transposones. Los polintones son transposones que derivan de virus de este dominio y están presentes en casi todos los eucariotas con excepción de las plantas, algas verdes y algas rojas. Los polintones se transmiten genéticamente de padres/madres a hijos.[1][9]
Un ejemplo peculiar de endogeneización en Varidnaviria son los virófagos, virus satélite que dependen de la infección con los virus gigantes para replicarse. Los virófagos se replican secuestrando los aparatos de replicación de los virus gigantes, suprimiendo así el número de viriones producidos por los virus gigantes, aumentando la probabilidad de supervivencia del huésped. Algunos virófagos pueden endogenizarse, y esta endogeneización puede considerarse una forma de inmunidad adaptativa para el huésped contra la infección por virus gigantes.[10]
Enfermedades y causas editar
Los virus procariotas de Varidnaviria como la familia Autolykiviridae, son potencialmente una de las principales causas de muerte entre los procariotas marinos. Este punto de vista se basa en que autolykivirus tienen rangos de hospederos amplios, que infectan y matan muchas cepas diferentes de diversas especies procariotas, en contraste con los virus procariotas con cola (caudovirus), que tienen rangos de hospedadores más limitados, así como en la aparentemente gran cantidad de virus procariotas marinos sin cola.[11] Los virus de protistas de la familia Phycodnaviridae desempeñan un papel importante en el control de la proliferación de algas y, con muchos virus marinos en general, contribuyen a un proceso llamado derivación viral mediante el cual el material orgánico de los organismos muertos es "desviado" por virus lejos de los niveles tróficos más altos y reciclado para el consumo por aquellos en niveles tróficos más bajos.[12]
Los virus causantes de enfermedades en animales más notables en Varidnaviria son los adenovirus, los poxvirus y el virus de la peste porcina africana (ASFV). Los adenovirus suelen causar enfermedades respiratorias, gastroenteritis y conjuntivitis, pero en ocasiones causan enfermedades más graves, como cistitis hemorrágica, hepatitis y meningoencefalitis.[13] Los poxvirus infectan a muchos animales y generalmente causan síntomas inespecíficos junto con una erupción característica que se llama viruela o también pox. Los poxvirus notables incluyen el virus Variola, que causó la viruela, el virus Vaccinia, que se usó como vacuna contra la viruela y al Molluscipoxvirus causante de la enfermedad molusco contagioso.[4] El virus de la peste porcina africana suele ser asintomático en sus reservorios naturales, pero causa una fiebre hemorrágica letal en los cerdos domésticos que es motivo de preocupación para la producción agrícola.[14][1]
Origen y evolución editar
Se ha sugerido que los virus de este dominio se originaron antes que el último antepasado común universal en los protobiontes durante la etapa final del mundo de ARN conocida como "mundo de ADN". Algunos virus de Varidnaviria (principalmente virus procariotas) tienen uracilo en su ADN denominado ADN-U, el uracilo es considerado un nucleótido típico del ARN. Este tipo de ADN está ausente en las células, por lo que dichos virus podrían representar una reliquia de la transición del ARN al ADN de dicho mundo. La fusión de un replicón con la ADN polimerasa y proteínas de dominio cupin, TNF, Pro-PD, CBM, nucleoplasminas y la SJR-MCP vertical llevó a la formación de los viriones de Varidnaviria.[3][15] El dominio se divide evolutivamente en dos reinos Bamfordvirae que contiene los virus con pliegues doble (DJR-MCP) y Helvetiavirae que contiene los virus con pliegues (SJR-MCP). Los virus con pliegues DJR-MCP derivan de los virus con pliegues SJR-MCP tras la fusión de dos pliegues SJR-MCP para formar el auténtico (DJR-MCP).[3] Los virus DJR-MCP (reino Bamfordvirae) pudieron originar la superfamilia de transposones de ADN polintones (transposones que se encuentran en los genomas eucariotas), los plásmidos mitocondriales (plásmidos inactivos que se encuentran en las mitocondrias) y los plásmidos de levaduras (también llamados citoplasmáticos). Estos elementos genéticos móviles derivan de bacteriófagos emparentados con Tectiviridae, por infección viral. Se cree que los bacteriófagos emparentados con Tectiviridae originaron primero a los polintones también llamados "polintovirus" que serían los primeros virus eucariotas y antes de integrarse al genoma eucariota originarían a los adenovirus, los virófagos, los virus gigantes, los plásmidos mitocondriales, los plásmidos de levaduras también llamados "citoplasmáticos" y los transpovirones (transposones de ADN que se encuentran en los genomas de los virus gigantes). Los polintovirus finalmente terminarían por endogenizarse en el genoma de los eucariotas convirtiendóse en los transposones polintones.[1][6][16][17] Los virus gigantes parecen haber evolucionado de virus pequeños descendientes de los polintovirus, que aumentaron su genoma y el tamaño del virión mediante la duplicación y deleción de genes, la inclusión de elementos genéticos móviles y la adquisición masiva de genes del huésped y sus bacterias endosimbióticas, incluidos los genes para la traducción y los genes informáticos que se consideran los más resistentes a la transferencia horizontal.[18][19][20][21][22] Los virus gigantes pudieron haber dado origen a los virus de la clase Naldaviricetes o descender de un ancestro compartido.[23][24][25]
Los virus gigantes son uno de los grupos de virus más cercanos a los organismos celulares según estudios proteicos, esto sugiere que este dominio puede ser parafilético y haya tenido linajes muy antiguos ahora extintos.[26]
Taxonomía editar
Se ha definido los siguientes taxones aproximadamente según ICTV y otros estudios:[27]
- Dominio Varidnaviria
- Reino Bamfordvirae
- Filo Nucleocytoviricota
- Filo Preplasmiviricota
- Clase Naldaviricetes[23][24]
- Reino Helvetiavirae
- Orden Halopanivirales
- Familia Portogloboviridae[3]
- Reino Bamfordvirae
Filogenia editar
Análisis de las proteínas que codifican la ADN polimerasa han dado el siguiente resultado y también se incluye los transposones polintones, los plásmidos mitocondriales y los plásmidos de levaduras (citoplasmáticos):[3][23][11]
| Varidnaviria | |
Otras filogenias proteicas basadas en el totalidad de proteínas sin los elementos genéticos móviles. Pero incluyendo los organismos celulares y los virus de ARN han dado un resultado algo diferente:[28][29]
| Biota |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Referencias editar
- ↑ a b c d e f g h i j Koonin EV, Dolja VV, Krupovic M, Varsani A, Wolf YI, Yutin N, Zerbini M, Kuhn JH (18 de octubre de 2019). «Create a megataxonomic framework, filling all principal taxonomic ranks, for DNA viruses encoding vertical jelly roll-type major capsid proteins» (docx). International Committee on Taxonomy of Viruses (en inglés). Consultado el 10 de junio de 2020.
- ↑ Eugene Koonin, Valerian V Doljja (2014). Virus World as an Evolutionary Network of Viruses and Capsidless Selfish Elements. Microbiology and Molecular Biology Reviews.
- ↑ a b c d e Krupovic, M; Dolja, VV; Koonin, EV (14 de julio de 2020). «The LUCA and its complex virome.». Nat Rev Microbiol. PMID 32665595. doi:10.1038/s41579-020-0408-x. Consultado el 16 de agosto de 2020.
- ↑ a b Meyer H, Ehmann R, Smith GL (February 2020). «Smallpox in the Post-Eradication Era». Viruses 12 (2): 138. PMC 7077202. PMID 31991671. doi:10.3390/v12020138. Consultado el 10 de junio de 2020.
- ↑ a b c d Klose T, Rossman MG (July 2014). «Structure of large dsDNA viruses». Biol Chem 395 (0): 711-719. PMC 4307781. PMID 25003382. doi:10.1515/hsz-2014-0145. Consultado el 10 de junio de 2020.
- ↑ a b c d e San Martin J, van Raaij MJ (23 de noviembre de 2018). «The So Far Farthest Reaches of the Double Jelly Roll Capsid Protein Fold». Virol J 15 (1): 181. PMC 6260650. PMID 30470230. doi:10.1186/s12985-018-1097-1. Consultado el 10 de junio de 2020.
- ↑ a b c d Iyer LM, Makarova KS, Koonin EV, Aravind L (2004). «Comparative genomics of the FtsK–HerA superfamily of pumping ATPases: implications for the origins of chromosome segregation, cell division and viral capsid packaging». Nucleic Acids Res 32 (17): 5260-5279. PMC 521647. PMID 15466593. doi:10.1093/nar/gkh828. Consultado el 10 de junio de 2020.
- ↑ Koonin, EV, Krupovic M (August 2017). «Polintons, virophages and transpovirons: a tangled web linking viruses, transposons and immunity». Curr Opin Virol 25: 7-15. PMC 5610638. PMID 28672161. doi:10.1016/j.coviro.2017.06.008. Consultado el 10 de junio de 2020.
- ↑ Campbell S, Aswad A, Katzourakis A (August 2017). «Disentangling the Origins of Virophages and Polintons». Curr Opin Virol 25: 59-65. PMID 28802203. doi:10.1016/j.coviro.2017.07.011. Consultado el 10 de junio de 2020.
- ↑ Mougari S, Sahmi-Bounsiar D, Levasseur A, Colson P, La Scola B (August 2019). «Virophages of Giant Viruses: An Update at Eleven». Viruses 11 (8): 733. PMC 6723459. PMID 31398856. doi:10.3390/v11080733.
- ↑ a b Kauffman KM, Hussain FA, Yang J, Arevalo P, Brown JM, Chang WK, VanInsberghe D, Elsherbini J, Sharma RS, Cutler MB, Kelly L, Polz MF (1 de febrero de 2018). «A Major Lineage of Non-Tailed dsDNA Viruses as Unrecognized Killers of Marine Bacteria». Nature 554 (7690): 118-122. PMID 29364876. doi:10.1038/nature25474.
- ↑ Van Etten JL, Dunigan DD (August 2016). «Giant Chloroviruses: Five Easy Questions». PLoS Pathog 12 (8): e1005751. PMC 4990331. PMID 27536965. doi:10.1371/journal.ppat.1005751. Consultado el 10 de junio de 2020.
- ↑ Lynch JP, Kajon, AE (August 2016). «Adenovirus: Epidemiology, Global Spread of Novel Serotypes, and Advances in Treatment and Prevention». Semin Respir Crit Care Med 37 (4): 586-602. PMC 7171713. PMID 27486739. doi:10.1055/s-0036-1584923. Consultado el 10 de junio de 2020.
- ↑ Galindo I, Alonso C (May 2017). «African Swine Fever Virus: A Review». Viruses 9 (5): 103. PMC 5454416. PMID 28489063. doi:10.3390/v9050103. Consultado el 10 de junio de 2020.
- ↑ Eugene V. Koonin, Mart Krupovic, and Vadim I. Agol, 2021. The Baltimore Classification of Viruses 50 Years Later: How Does It Stand in the Light of Virus Evolution?. American Society of Microbiogy.
- ↑ Error en la cita: Etiqueta
<ref>no válida; no se ha definido el contenido de las referencias llamadasyutin - ↑ Krupovic M, Bamford DH, Koonin EV (29 de abril de 2014). «Conservation of major and minor jelly-roll capsid proteins in Polinton (Maverick) transposons suggests that they are bona fide viruses». Biol Direct 9: 6. PMC 4028283. PMID 24773695. doi:10.1186/1745-6150-9-6. Consultado el 10 de junio de 2020.
- ↑ Natalya Yutin, Eugene Koonin (2019). Chapter Five - Evolution of the Large Nucleocytoplasmic DNA Viruses of Eukaryotes and Convergent Origins of Viral Gigantism. Science Direct.
- ↑ Natalya Yutin, Yuri I.Wolf, Eugene V.Koonin (2014). Origin of giant viruses from smaller DNA viruses not from a fourth domain of cellular life. Science Direct. https://doi.org/10.1016/j.virol.2014.06.032
- ↑ Jonathan Filée (2013). Route of NCLDV evolution: the genomic accordion. Science Direct.
- ↑ David Moreira, Céline Brochier-Armanet (2008). Giant viruses, giant chimeras: The multiple evolutionary histories of Mimivirus genes. NCBI.
- ↑ Tom Williams, T Martin Embley, Eva Heinz (2011). Informational Gene Phylogenies Do Not Support a Fourth Domain of Life for Nucleocytoplasmic Large DNA Viruses. Researchgate.
- ↑ a b c Eugene V. Koonin, Valerian V. Dolja, Mart Krupovic (2015). Origins and evolution of viruses of eukaryotes: The ultimate modularity. Sciences Direct.
- ↑ a b Eugene V. Koonin, Valerian V. Dolja, Mart Krupovic, Arvind Varsani, Yuri I. Wolf, Natalya Yutin, F. Murilo Zerbini, Jens H. Kuhn (2020). Global Organization and Proposed Megataxonomy of the Virus World. American Society for Microbiology.
- ↑ Johannes Jehlea, Yongjie Wang (2012). Phylogeny and Evolution of Hytrosaviridae. Science Direct.
- ↑ Arshan, Nasir; Caetano-Anollés, Gustavo (25 de septiembre de 2015). «A phylogenomic data-driven exploration of viral origins and evolution». Science Advances 1 (8): e1500527. Bibcode:2015SciA....1E0527N. PMC 4643759. PMID 26601271. doi:10.1126/sciadv.1500527.
- ↑ «Virus Taxonomy: 2023 Release» (html). International Committee on Taxonomy of Viruses (ICTV) (en inglés). Abril 2022. Consultado el 22 de abril de 2022.
- ↑ Arshan Nasir, Kyung Mo Kim, Gustavo Caetano-Anolles (2012). Giant viruses coexisted with the cellular ancestors and represent a distinct supergroup along with superkingdoms Archaea, Bacteria and Eukarya. BMC Evolutionary Biology.
- ↑ Rijja Hussain Bokhari, Nooreen Amirjan, Hyeonsoo Jeong, Kyung Mo Kim, Gustavo Caetano-Anollés, Arshan Nasir (2020). Bacterial Origin and Reductive Evolution of the CPR Group. Oxford Academic. https://doi.org/10.1093/gbe/evaa024