Glomerulonefritis
La glomerulonefritis es una enfermedad que afecta la estructura y la función del glomérulo, aunque posteriormente pueden resultar afectadas las demás estructuras de la nefrona.[1] Se trata de una enfermedad renal que puede tener varias causas y presentaciones clínicas y en la que se daña el sector de los riñones que ayuda a filtrar los desechos y los líquidos de la sangre.[2] El término genérico glomerulonefritis (que implica una patogenia inmune o inflamatoria) designa varias enfermedades renales, por lo general de naturaleza bilateral. Muchas de esas enfermedades se caracterizan por la inflamación de los glomérulos o los pequeños vasos sanguíneos de los riñones, de ahí su nombre, pero no todas tienen un componente inflamatorio.[3]
| Glomerulonefritis | ||
|---|---|---|
 | ||
| Especialidad | nefrología | |
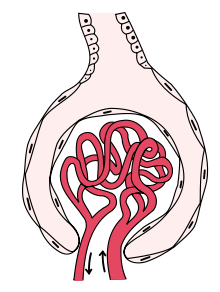
Como en términos estrictos no se trata de una única enfermedad, su presentación depende de la entidad patológica específica: puede presentarse con hematuria, proteinuria o ambas afecciones o como un síndrome nefrótico, un síndrome nefrítico, una lesión renal aguda o una enfermedad renal crónica.[4]
Clasificación editar
La glomerulonefritis puede ser primaria o secundaria. Se habla de glomerulonefritis primaria cuando el compromiso renal no es consecuencia de una enfermedad más general y las manifestaciones clínicas se limitan al riñón y de glomerulonefritis secundaria cuando la afección es resultado de una enfermedad sistémica (p. ej., lupus eritematoso sistémico, diabetes, etc.) o de una infección. Entre las glomerulonefritis primarias[1] figuran la nefropatía por IgA o por IgM, la glomerulonefritis proliferativa mesangial y la glomerulonefritis membranoproliferativa. En cuanto a las glomerulonefritis secundarias, pueden ser consecuencia de una infección bacteriana, viral o parasitaria o de enfermedades multisistémicas.[5]
En síntesis, las causas primarias son intrínsecas, es decir intrarrenales, y las secundarias son extrínsecas y se asocian con infecciones (causadas por bacterias, virus o parásitos), con ciertas drogas o con trastornos sistémicos (p. ej., lupus, vasculitis o diabetes).
Algunos autores[1] dividen las glomerulonefritis según su patrón anatomopatológico y las agrupan en dos categorías amplias, a saber, de tipo proliferativo y de tipo no proliferativo. Entre las de tipo proliferativo (es decir las caracterizadas por un aumento del número de algunas células glomerulares) se encuentran la glomerulonefritis mesangial por IgA y la glomerulonefritis mesangial por IgM, la glomerulonefritis membranoproliferativa o mesangiocapilar, la glomerulonefritis posestreptocócica o endocapilar difusa y la glomerulonefritis extracapilar. A su vez, las de tipo no proliferativo (o sea sin aumento del número de células de los glomérulos) incluyen la nefropatía por cambios mínimos, la glomeruloesclerosis segmentaria y focal y la glomerulonefritis membranosa o extramembranosa. La determinación del patrón histológico de la glomerulonefritis es importante porque el pronóstico y el tratamiento difieren según el tipo.[1]
Como las glomerulonefritis primarias son entidades muy heterogéneas tanto por su etiología como por su evolución no es posible establecer una clasificación única que permita diferenciarlas en grupos homogéneos. Sin embargo, si se consideran los datos evolutivos, histológicos y clínicos se las puede clasificar en diversos tipos.[6] Por ejemplo, de acuerdo con su evolución la glomerulonefritis puede ser aguda (forma que comienza en un momento conocido, habitualmente con síntomas claros, y que suele cursar con hematuria, a veces proteinuria, edema, hipertensión arterial e insuficiencia renal), subaguda (de comienzo menos claro, con un deterioro de la función renal que progresa en un plazo de semanas o meses y no muestra tendencia a la mejoría) y crónica (forma que independientemente del comienzo tiende a la cronicidad, suele cursar con hematuria, proteinuria, hipertensión arterial e insuficiencia renal y evoluciona en forma variable a lo largo de los años, pero tiende a progresar una vez que se instaura el daño).[1]
También se las puede clasificar según la histología, que es la clasificación más utilizada y aporta información útil para el pronóstico. Las diferentes enfermedades glomerulares pueden compartir las manifestaciones clínicas, lo que dificulta el diagnóstico y explica el papel decisivo que desempeña la biopsia. La biopsia renal permite establecer el diagnóstico correcto para administrar un tratamiento específico y también posibilita la detección de lesiones agudas o crónicas cuya naturaleza puede no ser sugerida por la historia clínica. Esto es importante porque el descubrimiento de lesiones más crónicas y potencialmente irreversibles evitaría el tratamiento de las lesiones con pocas probabilidades de responder.[7]
Por último, según el comportamiento del complemento las glomerulonefritis se pueden clasificar en las que cursan con complemento sérico normal y las que lo hacen con complemento reducido (sea en la fracción C3, en la fracción C4 o en ambas). Las que cursan con complemento normal son la enfermedad de cambios mínimos, la glomerulonefritis focal y segmentaria, la nefropatía por IgA, la glomerulonefritis membranosa primaria y la glomeruloesclerosis diabética. Las que se asocian con hipocomplementemia son la glomerulonefritis posestreptocócica (bajo nivel de C3), la glomerulonefritis lúpica (niveles bajos de C3 y C4), la glomerulonefritis membranoproliferativa de tipos I, II y III (bajo nivel de C3) y la glomerulonefritis asociada con crioglobulinemia[8] (nivel bajo de C4).[9]
Historia editar
Richard Bright, un médico inglés que hizo múltiples aportes a la medicina, entre ellos descripciones de enfermedades del sistema nervioso, el páncreas, el hígado y, especialmente, el riñón, publicó en 1827 su mayor contribución al campo de la patología renal, la descripción de la glomerulonefritis, término acuñado por Edwin Klebs en 1875 y utilizado como sinónimo de "enfermedad de Bright" desde que F. Volhard y T. Fahr lo introdujeron en su clasificación de las enfermedades renales en 1914.[10] Bright fue el primero en relacionar la presencia simultánea de albuminuria, hidropesía y lesión del parénquima renal y así identificó un nuevo tipo de enfermedad, en la que unía los signos clínicos con alteraciones químicas y cambios estructurales. Bright asociaba la observación clínica con pruebas de laboratorio en las que se analizaba la química de la orina y por último la necropsia permitía demostrar las alteraciones estructurales del riñón. Ese fue el criterio anatomoclínico que este investigador llevó a un nuevo escenario, el de la patología renal.[10]
En su trabajo titulado Reports of Medical Cases, ilustrado por él mismo, Bright describió las observaciones realizadas en pacientes que habían presentado edema y albuminuria tras padecer escarlatina.[11]
Epidemiología editar
Según el Registro Español de Glomerulonefritis, con datos obtenidos de 21.988 biopsias renales practicadas durante el período 1994-2013 (sin incluir biopsias de trasplantes), la nefropatía por IgA sigue siendo la patología más frecuente en las biopsias renales de ese país. La relación varones-mujeres es de 3:1. En los adultos la presentación más frecuente es como anomalías urinarias persistentes, pero en los mayores de 65 años se presenta más a menudo con disfunción renal aguda. El síndrome nefrótico se desarrolla en un trece por ciento de los casos, pero con más frecuencia en mayores de 65 años.
Hay un aumento progresivo de la edad de los pacientes sometidos a biopsia renal y el síndrome nefrótico es la causa más común. Las patologías observadas con más frecuencia son nefropatía por IgA y lupus eritematoso sistémico en los adultos y vasculitis y nefropatía membranosa en los mayores de 65 años. La disfunción renal aguda está incrementando su frecuencia como causa de biopsia renal, en especial en mayores de 65 años, y se asocia principalmente con vasculitis y con nefritis tubulointersticial aguda. La frecuencia de esta última enfermedad está aumentando, sobre todo en mayores de 65 años.[12]
Etiología editar
Las glomerulonefritis primarias son enfermedades de base inmunitaria, aunque en la mayor parte de los casos se desconoce el antígeno o causa última de la afección. La inmunidad desempeña un papel fundamental en el desencadenamiento de muchos tipos de lesiones glomerulares. En algunos casos la activación inespecífica de la inflamación puede causar o agravar la lesión glomerular. Los microorganismos infecciosos también pueden desencadenar respuestas inmunitarias anómalas o contra antígenos microbianos. Por último, los factores genéticos pueden ser causa de nefropatía glomerular, pero también pueden influir sobre la predisposición al desarrollo de lesión glomerular, sobre la progresión de esa lesión o sobre la respuesta al tratamiento.[1]
Patogenia editar
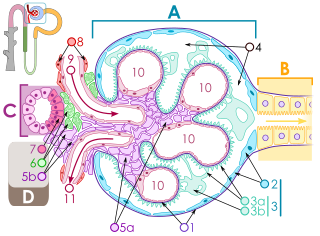
La glomerulonefritis es una enfermedad caracterizada por inflamación intraglomerular y proliferación celular asociada con hematuria en cuya patogenia desempeñan un papel importante tanto los mecanismos de inmunidad celular como los mecanismos humorales. El sistema del complemento también es importante. Su activación se asocia con patrones característicos de disminución de su concentración sérica, algunos de los cuales son prácticamente diagnósticos de ciertas nefritis.[9] La patogenia, entonces, puede ser inmunitaria o inflamatoria, con la participación de células y mediadores del sistema inmunitario, incluida la vía del complemento. Las células glomerulares intrínsecas, en particular los podocitos, son importantes en la lesión glomerular y en la respuesta a ella.[13]
Anatomía patológica editar
Clasificación histológica editar
Como ya se dijo, la glomerulonefritis puede tener una patogenia inmune o inflamatoria y aunque en algunas situaciones es posible establecer un diagnóstico específico sobre la base de la presentación clínica y las pruebas de laboratorio, en la mayor parte de los casos es útil realizar una biopsia renal tanto para efectuar la clasificación como para determinar el pronóstico. Además, lo ideal es que las muestras de biopsia se examinen con el microscopio óptico, mediante inmunofluorescencia y por microscopia electrónica porque ese enfoque permitirá diagnosticar el patrón histológico. En algunos casos ese patrón se puede comparar con los resultados de otras pruebas de laboratorio para identificar una etiología específica, pero en muchos otros la enfermedad es idiopática. Aun así, como los tratamientos suelen desarrollarse para patrones histológicos específicos, en el manejo actual de estos trastornos se prefiere este enfoque.[7]
Histopatología editar
La evaluación histopatológica completa de las muestras obtenidas para la biopsia renal requiere el empleo de microscopia óptica y electrónica y el examen con las técnicas de inmunofluorescencia o inmunoperoxidasa para detectar depósitos de complemento e inmunoglobulina.[7]
Microscopia óptica editar
En la glomerulonefritis las lesiones histológicas dominantes en la microscopia óptica, aunque no las únicas, se localizan en los glomérulos. La enfermedad se describe como focal (solo afecta algunos glomérulos) o difusa. En cualquier glomérulo individual la lesión puede ser segmentaria (afectar solo una parte del glomérulo) o global. En síntesis, las lesiones glomerulares pueden ser focales (solo presentes en algunos glomérulos) o difusas (presentes en todos o casi todos los glomérulos) y segmentarias (comprometer solo parte del glomérulo) o globales (con compromiso de todo el glomérulo).[14] Al obtener las muestras para la biopsia renal se pueden cometer errores. Por ejemplo, si la muestra es pequeña se puede juzgar erróneamente la extensión de una lesión focal y los cortes transversales pueden pasar por alto lesiones segmentarias. Las lesiones también pueden ser hipercelulares debido a un aumento de las células endoteliales o mesangiales endógenas (caso en el cual se las denomina proliferativas) o a la infiltración de leucocitos inflamatorios (en este caso se las llama exudativas). Cuando la inflamación es aguda e intensa puede provocar necrosis glomerular, la que a menudo es segmentaria. Además, es posible que se produzca un adelgazamiento de las paredes de los capilares glomerulares a causa de diversos procesos, entre ellos un aumento de los depósitos inmunes presentes en la membrana basal glomerular. También puede haber esclerosis y formación de cicatrices segmentarias, que se caracterizan por colapso capilar segmentario con acumulación de material hialino y de la matriz mesangial y muchas veces fijación de la pared capilar a la cápsula de Bowman (lo que determina la formación de sinequias[nota 1] o adherencias).[7]
Las tinciones clásicas que se utilizan en la microscopia óptica son hematoxilina-eosina y la reacción del ácido periódico de Schiff, que es particularmente útil para evaluar la celularidad y la expansión de la matriz. Las tinciones más específicas incluyen la tinción argéntica, que tiñe de negro la membrana basal glomerular y que puede revelar, entre otras cosas, un doble contorno de la membrana debido a la interposición de material celular o un aumento de la matriz mesangial que no sería fácil detectar con otras técnicas. La tinción tricrómica también es útil para detectar áreas con formación de cicatrices (que tiñe de azul) mientras que los depósitos inmunes se tiñen de rojo. Las semilunas, que son colecciones inflamatorias de células presentes en el espacio de Bowman, se desarrollan cuando se produce una lesión glomerular grave que determina la ruptura local de la pared capilar o de la cápsula de Bowman, lo que posibilita el ingreso de proteínas plasmáticas y material inflamatorio en el espacio homónimo. Las semilunas están compuestas por células epiteliales y parietales proliferantes, fibroblastos infiltrativos y además linfocitos y monocitos-macrófagos, muchas veces con depósitos locales de fibrina. Se las denomina semilunas por el aspecto que presentan en el corte en un plano del glomérulo para estudiar su histología. Son destructivas y su rápido aumento de tamaño conduce a la oclusión de las redes glomerulares. Si la lesión aguda cesa las semilunas pueden resolverse con restitución de la morfología normal o curar con fibrosis y causar la pérdida irreversible de la función renal. Las semilunas son más frecuentes en casos de vasculitis, en la enfermedad de Goodpasture y en las formas agudas graves de glomerulonefritis de cualquier etiología. En la glomerulonefritis también puede haber lesión tubulointersticial y fibrosis, las que posiblemente desempeñen un papel importante en el pronóstico.[7]
Técnicas con inmunofluorescencia e inmunoperoxidasa editar
Para identificar fenómenos reactivos inmunitarios se utilizan inmunofluorescencia indirecta y tinción con inmunoperoxidasa. La tinción se usa para detectar IgG, IgA e IgM, componentes del sistema del complemento (habitualmente C3, C4 y Clq) y fibrina, que suele verse en las semilunas y en los capilares en los trastornos trombóticos (como el síndrome urémico hemolítico y el síndrome antifosfolípidos). Puede haber depósitos inmunes a lo largo de las asas capilares o en el mesangio y es posible que sean continuos (lineales) o discontinuos (granulares).[7]
Cuadro clínico editar
Los síntomas comunes en los pacientes con glomerulonefritis incluyen hematuria, proteinuria y edema facial, edema palpebral y edema de los tobillos, los pies, las piernas o el abdomen. Otros síntomas posibles son dolor abdominal, hematemesis, melena, tos, disnea, diarrea, poliuria, fiebre, malestar general, fatiga, anorexia, artralgia y epistaxis. Si la enfermedad es crónica el paciente puede desarrollar síntomas con el tiempo.[15]
Diagnóstico editar
La glomerulonefritis es una causa importante de morbilidad y mortalidad y una causa potencialmente prevenible de enfermedad renal terminal de manera que es vital que se establezca el diagnóstico temprano para permitir la remisión oportuna de los pacientes a unidades especializadas en la biopsia renal.[13]
La función de filtración que desempeñan las estructuras glomerulares no solo supone la eliminación de agua sino también la eliminación selectiva de sustancias presentes en la sangre. Cualquier alteración que se produzca en estas estructuras anatómicas y fisiológicas dará lugar a anomalías en la labor de filtración que realicen. Dado que la proteinuria y la hematuria son hallazgos típicos, en la primera evaluación clínica habrá que determinar si hay proteinuria y, si la hay, cuál es su magnitud, la presencia de hematuria asociada, el desarrollo de insuficiencia renal y la existencia o no de hipertensión arterial.[16]
El mejor método para el diagnóstico de las enfermedades renales de etiología inmunitaria consiste en realizar la biopsia renal y estudiar con microscopia óptica los tejidos teñidos porque de ese modo se podrá anticipar el pronóstico y seleccionar el tratamiento adecuado. Sin embargo, como hay varios mecanismos inmunitarios que pueden provocar cambios morfológicos similares, también resulta útil la microscopia de inmunofluorescencia con anticuerpos específicos marcados con fluoresceína para determinar el tipo y la localización de los compuestos inmunes en el riñón.[17] Además, la biopsia renal es importante porque no solo permite saber dónde se encuentra la lesión histológica o qué mecanismos intervienen sino también el grado de importancia de dicha lesión, un factor fundamental para decidir qué tipo de manejo terapéutico se requiere y en qué momento iniciarlo.[16]
Se pueden emplear criterios clínicos, pero el diagnóstico requiere confirmación histológica con una sola excepción, a saber, la enfermedad por cambios mínimos en el niño. En ese caso se considera diagnóstica la respuesta positiva al tratamiento con esteroides.[16]
En la enfermedad renal mediada por anticuerpos (anticuerpos antimembrana basal glomerular, anticuerpos anti-HLA) los análisis serológicos pueden detectar anticuerpos citotóxicos en la circulación y en la granulomatosis de Wegener (una nefropatía mediada por anticuerpos anticitoplasma de neutrófilos o ANCA) se pueden encontrar ANCA circulantes.[17]
Las anomalías en la concentración de las proteínas del complemento en general permiten distinguir los tipos de nefropatía mediada por procesos inmunitarios. Cuando predomina la activación por vía alternativa (como sucede en la glomerulonefritis membranoproliferativa y con frecuencia en la posestreptocócica), el consumo de complemento empieza con la activación de C3, por lo que los primeros elementos del complemento (C1q, C4 y C2) no disminuyen. Cuando se activa la vía clásica (como en el lupus eritematoso sistémico), el consumo empieza en los primeros componentes, que por ende estarán disminuidos. La presencia de un factor nefrítico C3 con niveles bajos de C3 y normales de C1q, C4 y C2 es prácticamente diagnóstica de glomerulonefritis membranoproliferativa por activación de la vía alternativa.[17]
Diagnóstico diferencial editar
El diagnóstico diferencial de la glomerulonefritis sin enfermedad sistémica incluye glomerulonefritis posestreptocócica, nefropatía por IgA, glomerulonefritis rápidamente progresiva y glomerulonefritis membanoproliferativa. Es probable que la inflamación glomerular sea inducida directamente por una proteína estreptocócica nefritógena en la glomerulonefritis posestreptocócica y por el depósito mesangial de agregados inmunes con contenido de IgA1 de glicosilación anormal en la nefropatía por IgA. En la glomerulonefritis rápidamente progresiva con formación de semilunas cada vez está más claro que intervienen mecanismos inmunitarios celulares en lugar de humorales. En muchos pacientes con glomerulonefritis membanoproliferativa existe una infección crónica por el virus de la hepatitis C.[18]
Tratamiento editar
El tratamiento varía según la patogenia. Se han elaborado varias alternativas terapéuticas, pero muchas de estas enfermedades siguen siendo resistentes a todos los tratamientos. Por ejemplo, no existe una terapia específica eficaz para la glomerulonefritis posestreptocócica o la nefropatía por IgA. Habitualmente se aplican medidas generales y un tratamiento para aliviar los síntomas. Si hay infección activa se indica la antibioticoterapia correspondiente. Los pacientes con glomerulonefritis rápidamente progresiva se benefician con la administración de altas dosis de esteroides[nota 2] y terapia con drogas citotóxicas más el agregado de plasmaféresis en la enfermedad inducida por anticuerpos contra la membrana basal glomerular.[18] Los tratamientos antivirales reducen la gravedad de la glomerulonefritis membranoproliferativa debida al virus de la hepatitis C. Para hallar una terapéutica eficaz se están desarrollando nuevas formas de tratamiento dirigidas contra citocinas específicas, factores de crecimiento, depósito de fibrina y otros mediadores de la lesión así como formas más específicas y menos tóxicas de inmunoterapia.[18]
Los principios de los tratamientos nuevos incluyen la modulación de los mecanismos inmunitarios del huésped para eliminar el antígeno, el anticuerpo o los complejos inmunes, la inducción de inmunosupresión mediante fármacos inmunosupresores y la administración de agentes antiinflamatorios y, en algunos casos, de fármacos inhibidores de las plaquetas y anticoagulantes. Si no se logra la erradicación del antígeno habrá que reducir la carga antigénica y crear un exceso de anticuerpos para favorecer la eliminación de los complejos inmunes por el sistema fagocítico mononuclear normal. La plasmaféresis resulta beneficiosa en la enfermedad por anticuerpos antimembrana basal glomerular y el lupus eritematoso sistémico. Aparte del lupus y quizá también la glomerulonefritis membranosa pocas enfermedades responden a la administración de esteroides diarios o en dosis grandes. En la granulomatosis de Wegener y tal vez también en la glomerulonefritis membranosa y el lupus el fármaco de elección es la ciclofosfamida. Para la glomerulonefritis membranoproliferativa de tipo I el único tratamiento recomendado es la administración de inhibidores de las plaquetas (dipiridamol, aspirina y ticlopidina). Los niveles de anticuerpos citotóxicos son difíciles de reducir en la glomerulonefritis membranoproliferativa de tipo II a causa de la persistencia del antígeno estimulador.[17]
Uno de los primeros objetivos del tratamiento es el control de la presión arterial, lo que puede resultar muy difícil si los riñones funcionan mal. Cuando hay hipertensión se prescriben inhibidores de la enzima convertidora de angiotensina (p. ej., captopril) o antagonistas de los receptores de esa enzima (p. ej., losartán). Para reducir la inflamación desencadenada por la respuesta inmunitaria se indican corticosteroides y si no dan resultado se puede recurrir a la plasmaféresis (con la que parte del plasma se elimina y se reemplaza por líquidos intravenosos o plasma de donante —sin anticuerpos—).[19]
En la forma crónica de la enfermedad es preciso reducir la ingesta de proteínas, sal y potasio de la dieta. Es posible que se indiquen suplementos de calcio y que se requieran diuréticos para reducir el edema.
Si de todos modos la enfermedad avanza y el paciente desarrolla insuficiencia renal habrá que recurrir a la diálisis.[19]
Pronóstico editar
La glomerulonefritis puede ser una enfermedad temporal y reversible o puede empeorar. Es posible que la glomerulonefritis progresiva conduzca a insuficiencia renal crónica, deterioro de la función renal o enfermedad renal terminal. Si existe síndrome nefrótico y se lo puede controlar es posible que también se puedan controlar otros síntomas. En cambio, si no se lo puede controlar el resultado posible es una enfermedad renal terminal.[15]
Notas editar
- ↑ El término sinequia, que alude a la unión o adherencia anormal de tejidos u órganos, se usa especialmente en relación con el iris, el cristalino y la córnea pero es aplicable a todos los órganos en situaciones semejantes. Otra definición: any adhesion of parts of the body, as of the iris to the cornea (adherencia de cualquier parte del cuerpo, como la adherencia del iris a la córnea).
- ↑ Si bien el tratamiento con esteroides, asociados con otros agentes inmunosupresores o no, es eficaz en muchas formas de glomerulonefritis, la toxicidad es problemática. Una mejor comprensión de la patogenia determinará formas más específicas de tratamiento en el futuro.[13]
Referencias editar
- ↑ a b c d e f Fernández Fresnedo G., "Glomerulonefritis primarias", cap. 2 en Nefrología 2010. DOI: 10.3265/Nefrologia.2010.pub1.ed80.chapter2790. Disponible en [1] (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última)..Consultado el 14 de mayo de 2015.
- ↑ Glomerulonefritis según MedlinePlus.
- ↑ Manual CTO de Medicina y Cirugía: “Nefrología”, Madrid, Grupo CTO, 2012, p. 45. ISBN: 978-84-15062-11-0C.
- ↑ Vilches A., “Enfermedades renales. Las glomerulopatías” (Internet). Consultado en [2] el 19 de junio de 2015.
- ↑ Wardle E.N., “Cells and Mediators in Glomerulonephritis”, Nephron 1988;49:265-276. DOI:10.1159/000185074. Resumen disponible en [3]. Consultado el 14 de mayo de 2015.
- ↑ Fernández Fresnedo G., “Glomerulonefritis primarias”. En: Lorenzo-Sellarés V. y López-Gómez J.M. (eds.), Nefrología al día [Internet], 2a ed., abril de 2012, Barcelona (España): Sociedad Española de Nefrología/Plusmedical. (http://dx.doi.org/10.3265/Nefrologia.2010.pub1.ed80.chapter2790). Disponible en [4] Archivado el 18 de mayo de 2015 en Wayback Machine.. Consultado el 10 de mayo de 2015.
- ↑ a b c d e f Johnson R.J., Floege J., Feehally J.,“Introduction to Glomerular Disease: Histologic Classification and pathogenesis”, en Comprehensive Clinical Nephrology, 4a ed., (2010), pp. 208-217. ISBN: 978-0-323-05876-6. Vista previa disponible en [5]. Consultado en mayo de 2015.
- ↑ Orellana Fernández R., Almirall Daly1 J., Navarro F.J.A., “Nefropatía asociada a infecciones víricas”, Rev Esp Patol. 2002, 35 (2). Disponible en [6].Consultado el 27 de mayo de 2015.
- ↑ a b Argote E., Castro A.L. y Otero L.M., Colom Med 2004, vol. 35, Nº 1. Consultado en [7] el 24 de mayo de 2015.
- ↑ a b Báguena, M.J., “Richard Bright (1789-1959)”, publicado en Historia de la medicina.org en febrero de 2000. Disponible en [8]. Consultado el 17 de mayo de 2015.
- ↑ «Primera descripción de la glomerulonefritis.». Archivado desde el original el 4 de marzo de 2016. Consultado el 1 de junio de 2015.
- ↑ Registro Español de Glomerulonefritis, datos generales correspondientes al período 1994-2013, Barcelona, 5 de octubre de 2014. Consultado en [9] el 29 de mayo de 2015.
- ↑ a b c Mathieson P., “Primary glomerular disease”, Medicine 2011, vol. 39, N° 8, pp. 456-463. DOI: [10] Resumen disponible en [11].
- ↑ Arias L.F. (ed.), “Patrones histológicos de lesión glomerular”, en Nefropatología (kidneypathology.com). Consultado en mayo de 2015 en [12].
- ↑ a b MedlinePlus, Enciclopedia médica, "Glomerulonefritis", actualizado en septiembre de 2011. Consultado en [13] el 28 de mayo de 2015.
- ↑ a b c Lavilla Royo F.J., Diagnóstico y tratamiento de la glomerulonefritis en clínica. Disponible en [14]. Consultado en mayo de 2015.
- ↑ a b c d Manual Merck, cap. 231 Enfermedades renales de mediación inmunológica (sic) (nefropatía inmune). Lesiones renales glomerulares, vasculares y tubulointersticiales mediadas por los mecanismos inmunes del huésped. Consultado el 3 de mayo de 2015.
- ↑ a b c Couser W.G., “Glomerulonephritis”, The Lancet 353 (9163):1509-1515. DOI:10.1016/S0140-6736(98)06195-9. Resumen disponible en [15]. Consultado el 14 de abril de 2015.
- ↑ a b Case-Lo Chr., “Glomerulonephritis: Causes, Symptoms and Treatment”, publicado el 21 de julio de 2012 y revisado por Peter Rudd, MD. Consultado en [16] el 28 de mayo de 2015.
Enlaces externos editar
- Las glomerulopatías infantiles al albor del nuevo milenio.
- «Gomerulonefritis». MedLinePlus.
- «Los riñones y cómo funcionan». National Kidney and Urologic Diseases Information Clearinghouse (NKUDIC). Archivado desde el original el 23 de abril de 2014. Consultado el 17 de abril de 2014.