Hibridoma
Un hibridoma es una línea celular híbrida obtenida mediante la fusión de un linfocito B productor del anticuerpo específico de interés, con una línea celular de mieloma (linfocito B canceroso)[1] que no produce una inmunoglobulina propia. Se obtiene así una línea celular inmortal capaz de producir el anticuerpo monoclonal de interés, que puede recuperarse del medio.

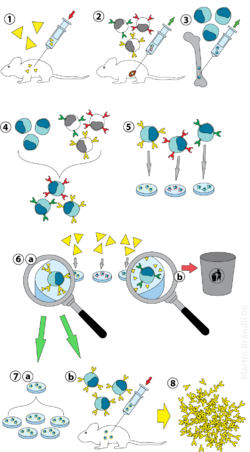
(2) Aislamiento de linfocitos B del bazo
(3) Cultivo de células de mieloma
(4) Fusión de mieloma y células B
(5) Separación de las líneas celulares
(6) Screening de las líneas celulares que producen el anticuerpo adecuado (a) y desecho del resto (b)
(7) Proliferación in vitro (a) or in vivo (b)
(8) Harvesting
Tecnología editar
La tecnología del hibridoma es un método para producir grandes cantidades de anticuerpos idénticos (también llamados anticuerpos monoclonales). Este proceso comienza inyectando a un ratón (u otro mamífero) un antígeno que provoca una respuesta inmunitaria. Un tipo de glóbulo blanco, el linfocito B, produce anticuerpos que se unen al antígeno inyectado. Estas células B productoras de anticuerpos se recogen del ratón y, a su vez, se fusionan con células cancerosas inmortales de células B, un mieloma para producir una línea celular híbrida llamada hibridoma, que tiene tanto la capacidad productora de anticuerpos de la célula B como la longevidad y reproductividad del mieloma.
Los hibridomas pueden cultivarse y cada cultivo comienza con una célula de hibridoma viable, produciendo cultivos cada uno de los cuales consta de hibridomas genéticamente idénticos que producen un anticuerpo por cultivo (monoclonales) en lugar de mezclas de diferentes anticuerpos (policlonales). La línea celular de mieloma que se utiliza en este proceso se selecciona por su capacidad para crecer en cultivo tisular y por la ausencia de síntesis de anticuerpos. A diferencia de los anticuerpos policlonales, que son mezclas de muchas moléculas de anticuerpos diferentes, los anticuerpos monoclonales producidos por cada línea de hibridoma son todos químicamente idénticos.
La producción de anticuerpos monoclonales fue inventada por César Milstein y Georges J. F. Köhler en 1975. Compartieron el Premio Nobel de Medicina y Fisiología de 1984 con Niels Kaj Jerne, que realizó otras aportaciones a la inmunología. El término hibridoma fue acuñado por Leonard Herzenberg durante su año sabático en el laboratorio de César Milstein en 1976-1977.[2]
Aplicaciones editar
Las aplicaciones de los anticuerpos monoclonales son numerosas e incluyen la prevención, el diagnóstico y el tratamiento de enfermedades. Por ejemplo, los anticuerpos monoclonales pueden distinguir subconjuntos de linfocitos B y linfocitos T, lo que resulta útil para identificar distintos tipos de leucemias. Además, se han utilizado anticuerpos monoclonales específicos para definir marcadores de superficie celular en los glóbulos blancos y otros tipos de células. Esto dio lugar a la serie de marcadores de diferenciación clúster. A menudo se denominan marcadores CD y definen varios cientos de componentes diferentes de la superficie celular de las células, cada uno de ellos especificado por la unión de un anticuerpo monoclonal concreto. Estos anticuerpos son extremadamente útiles para la clasificación celular activada por fluorescencia, el aislamiento específico de determinados tipos de células.
En histopatología diagnóstica editar
Con la ayuda de anticuerpos monoclonales, los tejidos y órganos pueden clasificarse en función de su expresión de ciertos marcadores definidos, que reflejan la génesis tisular o celular. El antígeno prostático específico, la fosfatasa alcalina placentaria, la gonadotrofina coriónica humana, la α-fetoproteína y otros son antígenos asociados a órganos y la producción de anticuerpos monoclonales contra estos antígenos ayuda a determinar la naturaleza de un tumor primario.[3]
Los anticuerpos monoclonales son especialmente útiles para distinguir lesiones morfológicamente similares, como el mesotelioma pleural y peritoneal, el adenocarcinoma, y para determinar el órgano o tejido de origen de las metástasis indiferenciadas. Algunos anticuerpos monoclonales ayudan a detectar metástasis ocultas (cáncer de origen primario desconocido) mediante el análisis inmunocitológico de médula ósea, aspirados de otros tejidos, así como de ganglios linfáticos y otros tejidos, y pueden tener una sensibilidad mayor que la tinción histopatológica normal.[3]
Un estudio[4] realizó un ensayo inmunohistoquímico sensible en aspirados de médula ósea de 20 pacientes con cáncer de próstata localizado. En el ensayo se utilizaron tres anticuerpos monoclonales (T16, C26 y AE-1), capaces de reconocer antígenos de membrana y citoesqueléticos expresados por células epiteliales para detectar células tumorales. Los aspirados de médula ósea del 22% de los pacientes con cáncer de próstata localizado (estadio B, 0/5; estadio C, 2/4), y del 36% de los pacientes con cáncer de próstata metastásico (estadio D1, 0/7 pacientes; estadio D2, 4/4 pacientes) presentaban células positivas al antígeno en la médula ósea. Se concluyó que las tinciones inmunohistoquímicas de los aspirados de médula ósea son muy útiles para detectar metástasis ocultas en la médula ósea en pacientes con cáncer de próstata aparentemente localizado.
Aunque la inmunocitoquímica con anticuerpos monoclonales asociados al tumor ha mejorado la capacidad de detectar células cancerosas de mama ocultas en aspirados de médula ósea y sangre periférica, es necesario seguir desarrollando este método antes de que pueda utilizarse de forma rutinaria.[5] Uno de los principales inconvenientes de la inmunocitoquímica es que sólo se utilizan anticuerpos monoclonales asociados al tumor y no específicos del tumor, por lo que puede producirse cierta reacción cruzada con células normales.[6]
Para estadificar eficazmente el cáncer de mama y evaluar la eficacia de los regímenes de purga previos a la infusión autóloga de células madre, es importante detectar incluso pequeñas cantidades de células cancerosas mamarias. Los métodos inmunohistoquímicos son ideales para este fin porque son sencillos, sensibles y bastante específicos. Franklin et al.[7] realizaron un ensayo inmunocitoquímico sensible utilizando una combinación de cuatro anticuerpos monoclonales (260F9, 520C9, 317G5 y BrE-3) contra glicoproteínas de superficie de células tumorales para identificar células tumorales de mama en médula ósea y sangre periférica. A partir de los resultados, concluyeron que la tinción inmunocitoquímica de la médula ósea y la sangre periférica es una forma sensible y sencilla de detectar y cuantificar las células del cáncer de mama.
Una de las principales razones de la recaída metastásica en pacientes con tumores sólidos es la diseminación precoz de las células malignas. El uso de anticuerpos monoclonales (mAbs) específicos para citoqueratinas puede identificar células tumorales epiteliales individuales diseminadas en la médula ósea.
Un estudio[8] informa de haber desarrollado un procedimiento inmunocitoquímico para el marcaje simultáneo del componente de citoqueratina n.º 18 (CK18) y el antígeno prostático específico (PSA). Esto ayudaría a caracterizar mejor las células tumorales epiteliales individuales diseminadas en pacientes con cáncer de próstata. Los doce aspirados de control procedentes de pacientes con hipertrofia prostática benigna mostraron tinción negativa, lo que respalda aún más la especificidad de la CK18 en la detección de células tumorales epiteliales en la médula ósea.
En la mayoría de los casos de enfermedad maligna complicada con derrame, las células neoplásicas pueden reconocerse fácilmente. Sin embargo, en algunos casos, las células malignas no se ven tan fácilmente o su presencia es demasiado dudosa como para calificarla de informe positivo. El uso de técnicas inmunocitoquímicas aumenta la precisión diagnóstica en estos casos.
Ghosh, Mason y Spriggs[9] analizaron 53 muestras de líquido pleural o peritoneal de 41 pacientes con enfermedad maligna. El examen citológico convencional no había revelado ninguna célula neoplásica. Se utilizaron tres anticuerpos monoclonales (anti-CEA, Ca 1 y HMFG-2) para buscar células malignas. El marcaje inmunocitoquímico se realizó en frotis sin teñir, que se habían conservado a -20 °C hasta 18 meses. Doce de los cuarenta y un casos en los que se realizó la tinción inmunocitoquímica revelaron la presencia de células malignas. El resultado representó un aumento de la precisión diagnóstica de aproximadamente el 20%. El estudio concluyó que, en pacientes con sospecha de enfermedad maligna, el etiquetado inmunocitoquímico debería utilizarse de forma rutinaria en el examen de muestras citológicamente negativas y tiene importantes implicaciones con respecto al tratamiento de los pacientes.
Otra aplicación de la tinción inmunocitoquímica es la detección de dos antígenos en el mismo frotis. La tinción doble con anticuerpos de cadena ligera y con marcadores de células T y B puede indicar el origen neoplásico de un linfoma.[10]
Un estudio ha informado del aislamiento de una línea celular de hibridoma (clon 1E10), que produce un anticuerpo monoclonal (IgM, isotipo k). Este anticuerpo monoclonal muestra una tinción inmunocitoquímica específica de los nucleolos.[11]
Los tejidos y los tumores pueden clasificarse en función de la expresión de determinados marcadores con la ayuda de anticuerpos monoclonales. Ayudan a distinguir lesiones morfológicamente similares y a determinar el origen orgánico o tisular de las metástasis indiferenciadas. El análisis inmunocitológico de médula ósea, aspirados tisulares, ganglios linfáticos, etc. con anticuerpos monoclonales seleccionados ayuda a detectar metástasis ocultas. Los anticuerpos monoclonales aumentan la sensibilidad para detectar incluso pequeñas cantidades de células invasoras o metastásicas. Los anticuerpos monoclonales (mAbs) específicos para citoqueratinas pueden detectar células tumorales epiteliales individuales diseminadas en la médula ósea.
Referencias editar
- ↑ FG-UCM, Prof, P, Gil-Loyzaga, Cátedra innovación y Salud, Fundación (2011-10). Cultivo de células animales y humanas: Aplicaciones en medicina regenerativa. Vision Libros. ISBN 978-84-9008-989-7. Consultado el 10 de julio de 2023.
- ↑ Milstein, C (1999). «The hybridoma revolution: an offshoot of basic research». BioEssays 21 (11): 966-73. PMID 10517870. doi:10.1002/(SICI)1521-1878(199911)21:11<966::AID-BIES9>3.0.CO;2-Z.
- ↑ a b Nelson, PN; Reynolds, GM; Waldron, EE; Ward, E; Giannopoulos, K; Murray, PG (2000). «Demystified ...: Monoclonal antibodies». Molecular Pathology 53 (3): 111-7. PMC 1186915. PMID 10897328. doi:10.1136/mp.53.3.111.
- ↑ Bretton, PR; Melamed, MR; Fair, WR; Cote, RJ (1994). «Detection of occult micrometastases in the bone marrow of patients with prostate carcinoma». Prostate 25 (2): 108-14. PMID 7518596. S2CID 32801503. doi:10.1002/pros.2990250208.
- ↑ Kvalheim, G (1996). «Detection of occult tumor cells in bone marrow and blood in breast cancer patients—methods and clinical significance». Acta Oncol 35: 13-18. PMID 9073044. doi:10.3109/02841869609098516.
- ↑ Kvalheim, G (1998). «Diagnosis of minimal residual disease in bone marrow and blood in cancer patients--methods and clinical implications». Acta Oncologica 37 (5): 455-62. PMID 9831374. doi:10.1080/028418698430403.
- ↑ Franklin, WA; Shpall, EJ; Archer, P; Johnston, CS; Garza-Williams, S; Hami, L; Bitter, MA; Bast, RC et al. (1996). «Immunocytochemical detection of breast cancer cells in marrow and peripheral blood of patients undergoing high dose chemotherapy with autologous stem cell support». Breast Cancer Res Treat 41 (1): 1-13. PMID 8932871. S2CID 37415751. doi:10.1007/BF01807031.
- ↑ Riesenberg, R; Oberneder, R; Kriegmair, M; Epp, M; Bitzer, U; Hofstetter, A; Braun, S; Riethmüller, G et al. (1993). «Immunocytochemical double staining of cytokeratin and prostate specific antigen in individual prostatic tumour cells». Histochemistry 99 (1): 61-6. PMID 7682210. S2CID 8007388. doi:10.1007/BF00268022.
- ↑ Ghosh, AK; Mason, D Y; Spriggs, A I (1983). «Immunocytochemical staining with monoclonal antibodies in cytologically "negative" serous effusions from patients with malignant disease». J Clin Pathol 36 (10): 1150-53. PMC 498493. PMID 6194182. doi:10.1136/jcp.36.10.1150.
- ↑ Ghosh, AK; Spriggs, AI; Taylor-Papadimitriou, J; Mason, DY (1983). «Immunocytochemical staining of cells in pleural and peritoneal effusions with a panel of monoclonal antibodies». J Clin Pathol 36 (10): 1154-64. PMC 498494. PMID 6194183. doi:10.1136/jcp.36.10.1154.
- ↑ Vissers, CJ; Flohil, CC; De Jong, AA; Dinjens, WN; Bosman, FT (1996). «A new monoclonal antibody for specific immunocytochemical staining of nucleoli». Acta Histochemica 98 (2): 113-21. PMID 8739296. doi:10.1016/S0065-1281(96)80028-6.
Enlaces externos editar
- Esta obra contiene una traducción derivada de «Hybridoma technology» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.