Nitrato de cadmio
El nitrato de cadmio se refiere a cualquiera de los compuestos inorgánicos de fórmula general Cd(NO3)2.xH2O. La forma anhidra es volátil pero las demás son sales. Todos son sólidos cristalinos incoloros que absorben la humedad del aire y se convierte en líquido, es decir, delicuescente. Los compuestos de cadmio son conocidos por ser carcinogénicos.
| Nitrato de cadmio | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Nitrato de cadmio | ||
| General | ||
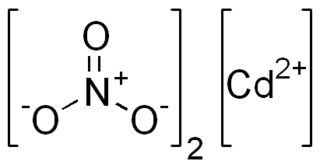
| Fórmula molecular | Cd(NO3)2.xH2O | |
| Identificadores | ||
| Número CAS |
10325-94-7 10022-68-1[1] | |
| ChEBI | CHEBI:77732 | |
| ChemSpider | 23498 | |
| PubChem | 25154 | |
| UNII | 3087 | |
|
[Cd+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O
| ||
| Propiedades físicas | ||
| Apariencia | Cristales blancos, higroscópico | |
| Olor | Inodoro | |
| Densidad | 3600 kg/m³; 3,6 g/cm³ | |
| Masa molar | 236,42 g/mol | |
| Punto de fusión | 633[2] | |
| Punto de ebullición | 405[2] | |
| Propiedades químicas | ||
| Solubilidad en agua |
109.7 g/100 mL (0 °C) 126.6 g/100 mL (18 °C) 139.8 g/100 mL (30 °C) 320.9 g/100 mL (59.5 °C)[3] | |
| Solubilidad | Soluble en ácidos, ammonio, alcoholes, éter, acetona | |
| Peligrosidad | ||
| NFPA 704 |
0
3
1
OX
| |
| Frases R | RR25, RR26, RR45, RR46, RR48/23/25, RR50/53, RR60, R61 | |
| Frases S | SS28, SS36/37, SS45, SS53, SS60, SS61 | |
| Riesgos | ||
| LD50 | 300 mg/kg (ratas, oral)[4] | |
| Compuestos relacionados | ||
| Otros cationes |
Nitrato de zinc Nitrato de calcio Nitrato de magnesio | |
| Otros aniones |
Cloruro de cadmio Sulfato de cadmio Acetato de cadmio | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Usos editar
El nitrato de cadmio se utiliza para la coloración del vidrio y la porcelana[5] y también como pólvora destellante en fotografía.
Preparación editar
El nitrato de cadmio se prepara disolviendo su metal, su óxido, hidróxido o carbonato en ácido nítrico, seguido por un proceso de cristalización.
- CdO + 2HNO3 → Cd(NO3)2 + H2O
- CdCO3 + 2 HNO3 → Cd(NO3)2 + CO2 + H2O
- Cd + 4 HNO3 → 2 NO2 + 2 H2O + Cd(NO3)2
Reacciones editar
La disociación térmica a temperaturas elevadas produce óxido de cadmio y óxidos de nitrógeno. Cuando se pasa a ácido sulfhídrico a través de una solución acidificada de nitrato de cadmio, sulfuro de cadmio. Una modificación roja del sulfuro se forma bajo condiciones de ebullición.
En una solución con soda cáustica, el óxido de cadmio forma un precipitado de hidróxido de cadmio. Varias sales insolubles de cadmio se obtienen mediante tales reacciones de precipitación.
Referencias editar
- ↑
10022-68-1 Número CAS - ↑ a b «Punto de fusión y de ebullición del nitrato de cadmio». Consultado el 16 de julio de 2021.
- ↑ Seidell, Atherton; Linke, William F. (1919). Solubilities of Inorganic and Organic Compounds (2nd edición). New York: D. Van Nostrand Company. p. 178.
- ↑ a b «MSDS of Cadmium nitrate tetrahydrate». https://www.fishersci.ca. Fisher Scientific. Consultado el 25 de junio de 2014.
- ↑ Karl-Heinz Schulte-Schrepping, Magnus Piscator "Cadmium and Cadmium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, 2007 Wiley-VCH, Weinheim. doi 10.1002/14356007.a04_499.
