Reacción de Duff
La reacción de Duff es una reacción de formilación de anillos aromáticos activados utilizando hexametilentetramina como fuente de grupos formilo.[1][2][3][4][5][6]

Las especies electrofílicas utilizadas en esta reacción de SEA es el ion iminio CH2+NR2. El producto de la reacción inicial es una imina hidrolizada a aldehído. La activación por parte de fenoles produce generalmente o-hidroxibenzaldehídos, mientras que las aminas primarias producen p-dialquilaminobenzaldehídos.
Algunos ejemplos de esta reacción son la síntesis del 3,5-Di-ter-butilsalicilaldehído[7]
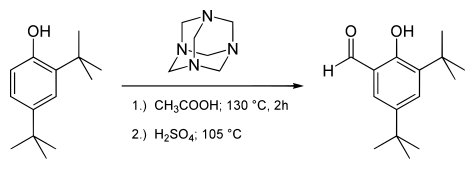
o la síntesis del siringaldehído:[8]

Mecanismo de reacción editar
El mecanismo mostrado a continuación[9] consiste en los siguientes pasos:
- La tetrametilenhexamina dona el carbono de un grupo formiliminio a un sustrato aromático por sustitución electrófila aromática, formando así la ciclohexanodienona como intermediario.
- La tautomería ceto-enólica se favorece por el restablecimiento de la aromaticidad.
- El siguiente átomo de nitrógeno vuelve a formar un grupo formiliminio, por eliminación de un tercer átomo de nitrógeno protonado para dar un grupo metilamino.
- Un grupo hidruro migra desde la posición bencílica hacia el carbono del formiliminio, generándose así el catión benzoiminio correspondiente.
- El benzoiminio se hidroliza, formando así el benzaldehído correspondiente.
Referencias editar
- ↑ Duff, J. C.; Bills, E. J. J. Chem. Soc. 1932, 1987.
- ↑ Duff, J. C.; Bills, E. J. J. Chem. Soc. 1934, 1305.
- ↑ Duff, J. C.; Bills, E. J. J. Chem. Soc. 1941, 547.
- ↑ Duff, J. C.; Bills, E. J. J. Chem. Soc. 1945, 276.
- ↑ Ferguson, L. N. (1946), «The Synthesis of Aromatic Aldehydes», Chem. Rev. 38: 227-254, PMID 21024865, doi:10.1021/cr60120a002..
- ↑ Ogata, Y.; Sugiura, F. Tetrahedron 1968, 24, 5001.
- ↑ 3,5-Di-tert-butylsalicylaldehyde in Organic Syntheses Coll. Vol. 10, p.96; Vol. 75, p.1 (Article Archivado el 30 de septiembre de 2007 en Wayback Machine.)
- ↑ C. F. H. Allen and Gerhard W. Leubner (1963). "Syringic aldehyde". Org. Synth.; Coll. Vol. 4: 866.
- ↑ Jerry March (2007). Advanced Organic Chemistry: Reactions, Mechanisms And Structure 6th Edition. New Jersey, US: Wiley. ISBN 978-0-471-72091-1.