Zona subventricular
La zona subventricular (ZSV o SVZ por sus siglas en inglés) es un término utilizado para describir tanto el tejido embrionario como el tejido neuronal adulto localizado bajo los ventrículos laterales del sistema nervioso central en los vertebrados. En la etapa embrionaria la ZSV refiere a una zona secundaria de proliferación que contiene células progenitoras neurales que se dividen para producir neuronas en el proceso llamado neurogénesis.[2] Las células madre neurales primarias del encéfalo y la médula espinal, llamadas células gliales radiales, residen en la zona ventricular (ZV) (llamada así porque la ZV delimita los ventrículos en el desarrollo).[3] Durante el desarrollo, la ZSV y la ZV de la corteza cerebral en el telencéfalo dorsal son tejidos transitorios que no existen en el adulto.[3] En cambio, la ZSV del telencéfalo ventral persiste a lo largo de la vida.
| Zona subventricular | ||
|---|---|---|
 La ZSV teñida en oscuro en cerebro de rata. | ||
| Sistema | SNC Sistema Nervioso Central | |
| Enlaces externos | ||
| NeuroLex ID | Subventricular Zone | |
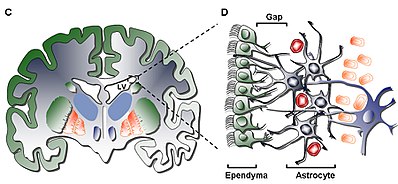

La ZSV adulta es una estructura apareada del encéfalo que se sitúa a a lo largo de las paredes laterales de los ventrículos laterales.[4] Está compuesta de cuatro capas de grosor, densidad y composición celular variable.[5] Junto con el giro dentado del hipocampo la ZSV es uno de los dos sitios donde se ha encontrado neurogénesis adulta en el cerebro de mamíferos adultos.[6] Las células generadas en la ZSV migran a través de la vía rostral migratoria hasta alcanzar el bulbo olfatorio.
Estructura editar
Capa I editar
La capa interior (Capa I) contiene una monocapa de células ependimarias que revisten la cavidad ventricular; estas células tienen un solo cilio apical y muchas expansiones basales que pueden estar tanto paralelas como perpendiculares a la superficie ventricular. Estas expansiones pueden interaccionar íntimamente con los procesos astrocíticos que las conectan con la capa hipocelular (Capa II).[5]
Capa II editar
La capa secundaria (Capa II) es una capa formada por un espacio hipocelular adyacente a la capa I que contiene una red funcional de procesos astrocíticos que expresan GFAP y que están relacionados entre sí y . Estos procesos forman complejos funcionales a pesar de que esta zona carece de cuerpos celulares a excepción de algún soma neuronal aislado. La función de esta capa es desconocida en humanos, sin embargo se ha hipotetizado que las conexiones entre astrocitos y las células ependimarias podrían estar regulando funciones neuronales como la homeostasis metabólica y/o el control de la proliferación de las células madre así como su diferenciación durante el desarrollo.[5]
Capa III editar
La capa terciaria (Capa III) la forma una cinta de cuerpos celulares de astrocitos que se cree que mantienen a una subpoblación de astrocitos capaces de proliferar in vivo y de formar neuroesferas multipotentes con capacidad de autorenovarse in vitro. También se encuentran algunos oligodendrocitos y célula ependimarias sin embargo son poco comunes en comparación con los astrocitos y no se conoce su función . Los astrocitos presentes en la capa III pueden dividirse en tres poblaciones al observarse al microscopio electrónico, pero no se conocen las funciones de cada una de ellas. El primer tipo lo forman pequeños astrocitos con proyecciones largas, horizontales y tangenciales que suelen encontrarse en la capa II; el segundo tipo se encuentra entre las capas II y III además de en la cinta de astrocitos, se caracteriza por su gran tamaño y por la presencia de muchos orgánulos; el tercer tipo se encuentra en los ventrículos laterales justo debajo del hipocampo y es de tamaño similar a los del segundo tipo pero contiene pocos orgánulos.[5]
Capa IV editar
La cuarta y última capa (Capa IV) sirve como zona de transición entre la Capa III y el parénquima cerebral. Se identifica por una alta presencia de mielina en la región.[5]
Tipos celulares editar
Se han descrito cuatro tipos celulares en la ZSV:[7]
1. Células ependimarias ciliadas (Tipo E): Se sitúan mirando al lumen del ventrículo, ayudando a la circulación del Fluido cerebroespinal.
2. Neuroblastos en proliferación (Tipo A): Expresan PSA-NCAM (NCAM1), Tuj1 (TUBB3), y Hu. Migran en línea al bulbo olfactorio
3. Células de proliferación lenta (Tipo B): expresan nestina y GFAP y su función consiste en envolver a los Neuroblastos tipo A.[8]
4. Células proliferando activamente o Progenitores amplificándose transitoriamente (Tipo C): expresan nestina, y forman grupos separados en toda la región.[9]
Función editar
La ZSV en un área conocida donde hay tanto neurogénesis como neuronas que se autorenuevan en el cerebro adulto gracias a la interacción entre sus tipos celulares, a moléculas extracelulares y a regulación epigenética localizada que promueve la proliferación celular.[10] Junto con la zona subgranular del giro dentado, la zona subventricular es un nicho de células madre neurales para el proceso de neurogenesis adulta. Aloja la mayor población de células proliferativas en el cerebro adulto de roedores, monos e humanos.[11] En 2010, se demostró que el balance entre células madres neurales y células progenitoras neurales se mantiene por una interacción entre la vía señalizada por el Receptor del factor de crecimiento epidérmico y la vía señalizada por Notch.[12]
Mientras que todavía no ha sido estudiada en profundidad en humanos, la función de la ZSV en roedores ha sido hasta cierto punto estudiada y definida. Con estas investigaciones se ha demostrado que los astrocitos con doble función son las células predominantes en la ZSV de roedores. Estos astrocitos no solo actúan como células madre neurales sino también como células de soporte que promueven la neurogénesis a través de su interacción con otras células.[7] Esta función es también inducida por la microglia y las células endoteliales que cooperan con las células madre neurales para promover la neurogenesis in vitro, así como por componentes de la matriz extracelular como la tenascina-C (que ayuda a definir los límites para la interacción) o Lewis X (que une factores de crecimmiento y de señalización a precursores neurales).[13] A pesar de ello la ZSV humana es diferente a la de roedores en dos aspectos diferentes: por una parte en roedores los astrocitos se encuentran yuxtapuestos a la capa de células ependimarias y en humanos están separados por una capa sin cuerpos celulares (Capa II); por otra parte la ZSV humana carece de cadenas de neuroblastos en migración como los que se han visto en roedores, proporcionando así una menor migración de neuronas en humanos que en roedores. Por esta razón, a pesar de que la ZSV de roedores es una fuente valiosa de información acerca de la relación entre la estructura y la función en la ZSV, el modelo humano es significativamente distinto.[4]
Además algunas teorías actuales proponen que la ZSV puede ser también un lugar de proliferación para células madre tumorales del cerebro (BTSCs por sus siglas en inglés) que son similares a células madre neurales en su estructura y en su capacidad de diferenciarse en neuronas, astrocitos y oligodendrocitos.[14] Algunos estudios han confirmado que una pequeña población de estas células puede producir no solo tumores sino que además pueden mantener a estos a través de su capacidad de autorenovarse y su capacidad de división multipotencial. A pesar de que esto no permite inferir directamente que las BTSCs sean producto de la división de células madre neurales esta similitud abre puertas para la investigación de la relación que existe entre estas células.
Véase también editar
Referencias editar
- ↑ Popp A, Urbach A, Witte OW, Frahm C (2009). «Adult and Embryonic GAD Transcripts Are Spatiotemporally Regulated during Postnatal Development in the Rat Brain». En Reh, Thomas A., ed. PLoS ONE 4 (2): e4371. PMC 2629816. PMID 19190758. doi:10.1371/journal.pone.0004371.
- ↑ Noctor, SC; Martínez-Cerdeño, V; Ivic, L; Kriegstein, AR (febrero de 2004). «Cortical neurons arise in symmetric and asymmetric division zones and migrate through specific phases.». Nature Neuroscience 7 (2): 136-44. PMID 14703572. doi:10.1038/nn1172.
- ↑ a b Rakic, P (octubre de 2009). «Evolution of the neocortex: a perspective from developmental biology.». Nature reviews. Neuroscience 10 (10): 724-35. PMC 2913577. PMID 19763105. doi:10.1038/nrn2719.
- ↑ a b
- ↑ a b c d e Quiñones-Hinojosa, A; Chaichana, K (Jun 2007). «The human subventricular zone: a source of new cells and a potential source of brain tumors.». Experimental neurology 205 (2): 313-24. PMID 17459377. doi:10.1016/j.expneurol.2007.03.016.
- ↑ Ming, GL; Song, H (26 de mayo de 2011). «Adult neurogenesis in the mammalian brain: significant answers and significant questions.». Neuron 70 (4): 687-702. PMC 3106107. PMID 21609825. doi:10.1016/j.neuron.2011.05.001.
- ↑ a b Doetsch, F; García-Verdugo, JM; Alvarez-Buylla, A (1 de julio de 1997). «Cellular composition and three-dimensional organization of the subventricular germinal zone in the adult mammalian brain.». The Journal of Neuroscience 17 (13): 5046-61. PMID 9185542.
- ↑ Luskin, MB (Jul 1993). «Restricted proliferation and migration of postnatally generated neurons derived from the forebrain subventricular zone.». Neuron 11 (1): 173-89. PMID 8338665. doi:10.1016/0896-6273(93)90281-U.
- ↑ Doetsch, F; Caillé, I; Lim, DA; García-Verdugo, JM; Alvarez-Buylla, A (11 de junio de 1999). «Subventricular zone astrocytes are neural stem cells in the adult mammalian brain.». Cell 97 (6): 703-16. PMID 10380923. doi:10.1016/S0092-8674(00)80783-7.
- ↑ Lim, DA; Alvarez-Buylla, A (22 de junio de 1999). «Interaction between astrocytes and adult subventricular zone precursors stimulates neurogenesis.». Proceedings of the National Academy of Sciences of the United States of America 96 (13): 7526-31. PMC 22119. PMID 10377448. doi:10.1073/pnas.96.13.7526.
- ↑ Gates, MA; Thomas, LB; Howard, EM; Laywell, ED; Sajin, B; Faissner, A; Götz, B; Silver, J et al. (16 de octubre de 1995). «Cell and molecular analysis of the developing and adult mouse subventricular zone of the cerebral hemispheres.». The Journal of Comparative Neurology 361 (2): 249-66. PMID 8543661. doi:10.1002/cne.903610205.
- ↑ Aguirre A, Rubio ME, Gallo V (septiembre de 1998). «Notch and EGFR pathway interaction regulates neural stem cell number and self-renewal». Nat.. 467 (7313): 323-7. PMC 2941915. PMID 20844536. doi:10.1038/nature09347.
- ↑ Bernier, PJ; Vinet, J; Cossette, M; Parent, A (mayo de 2000). «Characterization of the subventricular zone of the adult human brain: evidence for the involvement of Bcl-2.». Neuroscience research 37 (1): 67-78. PMID 10802345. doi:10.1016/S0168-0102(00)00102-4.
- ↑ Parent JM, von dem Bussche N, Lowenstein DH (2006). «Prolonged seizures recruit caudal subventricular zone glial progenitors into the injured hippocampus.». Hippocampus 16 (3): 321-8. PMID 16435310. doi:10.1002/hipo.20166.