Bromuro de cianógeno
El bromuro de cianógeno es un compuesto inorgánico con la fórmula (CN)Br o BrCN. Es un sólido incoloro que se usa ampliamente para modificar biopolímeros, proteínas de fragmentos y péptidos (corta el extremo C de metionina) y sintetizar otros compuestos. El compuesto se clasifica como pseudohalógeno.
| Bromuro de cianógeno | ||
|---|---|---|
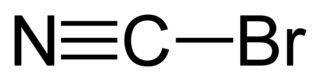 Fórmula esqueletal del bromuro de cianuro | ||
 Modelo de relleno espacial de bromuro de cianógeno | ||
| Nombre IUPAC | ||
| Bromuro carbononitrídico[1] | ||
| General | ||
| Otros nombres | Cianuro de bromo[2] | |
| Fórmula estructural |
| |
| Fórmula molecular | BrCN | |
| Identificadores | ||
| Número CAS | 506-68-3[3] | |
| Número RTECS | GT2100000 | |
| ChEMBL | CHEMBL3561885 | |
| ChemSpider | 10044 | |
| PubChem | 10476 | |
| UNII | OS382OHJ8P | |
|
BrC#N
| ||
| Propiedades físicas | ||
| Apariencia | Sólido incoloro | |
| Densidad | 2,015 kg/m³; 0,002015 g/cm³ | |
| Masa molar | 105 921 g/mol | |
| Punto de fusión | 50 °C (323 K) a 53 °C (326 K) | |
| Punto de ebullición | 61 °C (334 K) a 62 °C (335 K) | |
| Presión de vapor | 16,2 kPa | |
| Propiedades químicas | ||
| Solubilidad en agua | Reacciona | |
| Peligrosidad | ||
| SGA |
 , , , , | |
| NFPA 704 |
0
4
1
| |
| Frases H | H300,H310,H314,H330,H410 | |
| Frases P | P260,P273,P280,P284,P302+350 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Síntesis, propiedades básicas y estructura editar
El átomo de carbono en el bromuro de cianógeno se une al bromo mediante un solo enlace y al nitrógeno por un enlace triple (es decir, Br - C≡N). El compuesto es lineal y polar, pero no se ioniza espontáneamente en el agua. Se disuelve tanto en agua como en solventes orgánicos polares.
El bromuro de cianógeno se puede preparar mediante oxidación de cianuro de sodio con bromo, que procede en dos pasos a través del cianógeno intermedio ((CN)
2):
Cuando se refrigera, el material tiene una vida útil extendida. Al igual que algunos otros compuestos de cianógeno, el bromuro de cianógeno sufre una trimerización exotérmica al bromuro cianúrico ((CNBr)3). Esta reacción es catalizada por trazas de bromo, sales de metal, ácidos y bases.[4] Por esta razón, los experimentadores evitan las muestras marrón.[5] El bromuro de cianógeno se hidroliza para liberar cianuro de hidrógeno y ácido hipobromoso
Aplicaciones bioquímicas editar
Los principales usos del bromuro de cianógeno son inmovilizar proteínas, fragmentos de proteínas al escindir enlaces péptidos y sintetizar cianamidas y otras moléculas.
Inmovilización de proteínas editar
El bromuro de cianógeno a menudo se usa para inmovilizar proteínas acoplándolas a reactivos como agarosa para la cromatografía de afinidad.[6] Debido a su simplicidad y condiciones de pH suaves, la activación del bromuro de cianógeno es el método más común para preparar geles de afinidad. El bromuro de cianógeno también se usa a menudo porque reacciona con los grupos hidroxilo en agarosa para formar ésteres de cianato e imidocarbonatos. Estos grupos se reaccionan con aminas primarias para acoplar la proteína en la matriz de agarosa, como se muestra en la figura. Debido a que los ésteres de cianato son más reactivos que los imidocarbonatos cíclicos, la amina reaccionará principalmente con el éster, produciendo derivados de isourea, y en parte con los imidocarbonato menos reactivos, produciendo imidocarbonatos sustituidos.[7] Las desventajas de este enfoque incluyen la toxicidad del bromuro de cianógeno y su sensibilidad a la oxidación. Además, la activación del bromuro de cianógeno implica la unión de un ligando a agarosa mediante un enlace isourea, que se carga positivamente a pH neutro y, por lo tanto, inestable. En consecuencia, los derivados de isourea pueden actuar como intercambiadores de aniones débiles.[7]
Escisión de proteínas editar
El bromuro de cianógeno hidroliza los enlaces péptidos en el extremo C de los residuos de metionina. Esta reacción se usa para reducir el tamaño de los segmentos de polipéptidos para la identificación y secuenciación.
Mecanismo editar
La densidad de electrones en el bromuro de cianógeno se aleja del átomo de carbono, lo que la hace inusualmente electrofílica y hacia el bromo y el nitrógeno más electronegativos. Esto deja el carbono particularmente vulnerable al ataque por un nucleófilo, y la reacción de escisión comienza con una reacción de sustitución de acilo nucleofílico en la que el bromo es reemplazado por el azufre en la metionina. Este ataque es seguido por la formación de un anillo de cinco miembros en lugar de un anillo de seis miembros, que implicaría la formación de un doble enlace en el anillo entre nitrógeno y carbono. Este doble enlace daría como resultado una conformación rígida del anillo, desestabilizando así la molécula. Por lo tanto, el anillo de cinco miembros se forma para que el doble enlace esté fuera del anillo, como se muestra en la figura.
Aunque el azufre nucleofílico en la metionina es responsable de atacar BRCN, el azufre en la cisteína no se comporta de manera similar. Si el azufre en la cisteína atacó el bromuro de cianógeno, el ion bromuro desprotonaría el aducto de cianuro, dejando el azufre sin carga y el carbono beta de la cisteína no electrofílica. El electrófilo más fuerte sería el nitrógeno de cianuro, que, si se atacó por agua, produciría ácido ciánico y la cisteína original.
Condiciones de reacción editar
Las proteínas de escisión con BrCN requieren un tampón como HCl 0.1M (ácido clorhídrico) o 70% (ácido fórmico).[8] Estos son los amortiguadores más comunes para la escisión. Una ventaja para HCl es que el ácido fórmico provoca la formación de ésteres de formil, lo que complica la caracterización de la proteína. Sin embargo, el fórmico todavía se usa a menudo porque disuelve la mayoría de las proteínas. Además, la oxidación de la metionina al sulfóxido de metionina, que es inerte al ataque de BrCN, ocurre más fácilmente en HCl que en el ácido fórmico, posiblemente porque el ácido fórmico es un ácido reductor. Los tampones alternativos para la escisión incluyen guanidina o urea en HCl debido a su capacidad de desplegar proteínas, lo que hace que la metionina sea más accesible para BrCN.[9]
Hay que tener en cuenta que se requiere agua para la escisión normal del enlace peptídico del intermedio de la iminolactona. En el ácido fórmico, la escisión de los enlaces MET-Ser y MET-THR se mejora con una mayor concentración de agua porque estas condiciones favorecen la adición de agua a través de la imina en lugar de la reacción de la cadena lateral hidroxilo con la imina. El pH reducido tiende a aumentar las tasas de escisión al inhibir la oxidación de la cadena lateral de metionina.[9]
Reacciones laterales editar
Cuando la metionina es seguida por serina o treonina, pueden ocurrir reacciones laterales que destruyen la metionina sin escisión del enlace péptido. Normalmente, una vez que se forma la iminolactona (consulte la figura), el agua y el ácido pueden reaccionar con la imina para escindir el enlace péptido, formando una lactona homoserina y un nuevo péptido C-terminal. Sin embargo, si el aminoácido adyacente a la metionina tiene un grupo de hidroxilo o sulfhidrilo, este grupo puede reaccionar con la imina para formar una homoserina sin escisión del enlace péptido.[9] Estos dos casos se muestran en la figura.
Síntesis orgánica editar
El bromuro de cianógeno es un reactivo común en la síntesis orgánica.[5] Como se indicó anteriormente, el reactivo es propenso a atacar por nucleófilos como aminas y alcoholes debido al carbono electrofílico. En la síntesis de cianamidas y dicyanamidas, las aminas primarias y secundarias reaccionan con BrCN para producir mono y dialquilcyanamidas, lo que puede reaccionar aún más con aminas e hidroxilamina para producir guanidinas e hidroxyguanidinas. En la reacción de von Braun, las aminas terciarias reaccionan con BrCN para producir cianamidas desubstituidas y un bromuro de alquilo. El bromuro de cianógeno se puede usar para preparar nitrilos arílicos, nitrilos, anhídridos y cianatos. También puede servir como agente de escisión.[10] El bromuro de cianógeno se usa en la síntesis de 4-metilaminorex ('hielo') y viroxime.
Toxicidad, almacenamiento y desactivación editar
El bromuro de cianógeno se puede almacenar en condiciones secas a 2 a 8 °C durante períodos prolongados.[7]
El bromuro de cianógeno es volátil y se absorbe fácilmente a través de la piel o el tracto gastrointestinal. Por lo tanto, la exposición tóxica puede ocurrir por inhalación, contacto físico o ingestión. Es muy tóxico, causando una variedad de síntomas inespecíficos. La exposición incluso a pequeñas cantidades puede causar convulsiones o muerte. DL50 por vía oral en ratas se informa como 25–50 mg/kg.[11]
El PEL, límite legal de exposición admisible en el aire, es de 5 mg/m3 (como cianuros) como promedio durante un turno laboral de 8 horas. El límite de exposición ya mencionado es solamente para los niveles en el aire. La sobreexposición puede ocurrir aun si los niveles en el aire son inferiores al límite ya mencionado si también hay contacto con la piel.[12]
El método recomendado para desactivar el bromuro de cianógeno es con hidróxido de sodio y blanqueador.[13] El hidróxido alcalino acuoso se hidroliza instantáneamente (CN)Br a cianuro y bromuro alcalino. El cianuro se puede oxidar por hipoclorito de sodio o calcio al ion menos tóxico de cianato. Tenga en cuenta que la desactivación es extremadamente exotérmica y puede ser explosiva.[11]
Referencias editar
- ↑ «Cyanogen Bromide – Compound Summary». PubChem Compound. USA: National Center for Biotechnology Information. 26 de marzo de 2005. Identification. Consultado el 4 de junio de 2012.
- ↑ The Merck Index (10th edición). Rahway, NJ: Merck & Co. 1983. p. 385.
- ↑ Número CAS
- ↑ Morris, Joel; Kovács, Lajos; Ohe, Kouichi (2015). «Cyanogen Bromide». Encyclopedia of Reagents for Organic Synthesis. pp. 1-8. ISBN 9780470842898. doi:10.1002/047084289X.rc269.pub3.
- ↑ a b Joel Morris; Lajos Kovács (2008). «Cyanogen Bromide». Encyclopedia of Reagents for Organic Synthesis. ISBN 978-0471936237. doi:10.1002/047084289X.rc269.pub2.
- ↑ Hermanson, G. T.; Mallia, A. K.; Smith, P. K. (1992). Immobilized Affinity Ligand Techniques. Academic Press. ISBN 978-0-12-342330-6.
- ↑ a b c «Cyanogen Bromide Activated Matrices». Sigma.
- ↑ Schroeder, W. A.; Shelton, J. B.; Shelton, J. R. (1969). «An Examination of Conditions for the Cleavage of Polypeptide Chains with Cyanogen Bromide». Archives of Biochemistry and Biophysics 130 (1): 551-556. PMID 5778667. doi:10.1016/0003-9861(69)90069-1.
- ↑ a b c Kaiser, R.; Metzka, L. (1999). «Enhancement of Cyanogen Bromide Cleavage Yields for Methionyl-Serine and Methionyl-Threonine Peptide Bonds». Analytical Biochemistry 266 (1): 1-8. PMID 9887207. doi:10.1006/abio.1998.2945.
- ↑ Kumar, V. (2005). «Cyanogen Bromide (CNBr)». Synlett 2005 (10): 1638-1639. doi:10.1055/s-2005-869872. Art ID: V12705ST.
- ↑ a b «Cyanogen Bromide HSDB 708». HSDB. NIH / NLM. 7 de abril de 2009.
- ↑ https://www.nj.gov/health/eoh/rtkweb/documents/fs/2302sp.pdf
- ↑ Lunn, G.; Sansone, E. B. (1985). «Destruction of Cyanogen Bromide and Inorganic Cyanides». Analytical Biochemistry 147 (1): 245-250. PMID 4025821. doi:10.1016/0003-2697(85)90034-X.
