Cabergolina
La cabergolina es un derivado sintético de la ergolina que actúa como agonista dopaminérgico con alta afinidad por los receptores de dopamina tipo D2 en células lactotropas de la hipófisis y del receptor 5-HT2B de serotonina[1]. Se administra por vía oral y está indicada para disminuir las concentraciones de prolactina en hiperprolactinemia fisiológica o patológica[2]. También está indicado para acromegalia, en combinación con análogos de la somatostatina para normalizar concentraciones de la hormona de crecimiento y factor de crecimiento similar a la insulina tipo 1 (IGF-1)[3][4].
| Cabergolina | ||
|---|---|---|
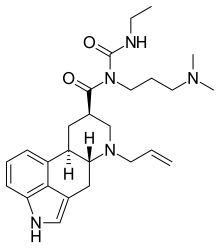 | ||
| Nombre (IUPAC) sistemático | ||
|
Nombre IUPAC N-[3-(Dimetillamino)propil]-N-[(etilamino)carbonil]- 6-(2-propenil)-8g-ergolin-8-carboxamida
| ||
| Identificadores | ||
| Número CAS | 81409-90-7 | |
| Código ATC | G02CB03 | |
| PubChem | 54746 | |
| DrugBank | APRD00836 | |
| UNII | LL60K9J05T | |
| Datos químicos | ||
| Fórmula | C26H37N5O2 | |
| Peso mol. | 451.604 g/mol | |
|
InChI=1S/C26H37N5O2/c1-5-11-30-17-19(25(32)31(26(33)27-6-2)13-8-12-29(3)4)14-21-20-9-7-10-22-24(20)18(16-28-22)15-23(21)30/h5,7,9-10,16,19,21,23,28H,1,6,8,11-15,17H2,2-4H3,(H,27,33)/t19-,21-,23-/m1/s1
Key: KORNTPPJEAJQIU-KJXAQDMKSA-N | ||
| Farmacocinética | ||
| Biodisponibilidad | Se ha observado el efecto de primera etapa, pero la biodisponibilidad absoluta es desconocida | |
| Unión proteica | Unión moderada (entre 40-42%) concentración-independiente | |
| Metabolismo | Hepático, predominantemente por escisión del enlace acilurea de la porción urea | |
| Vida media | 63-69 h (estimada) | |
| Excreción | orina (22%), Heces (60%) | |
| Datos clínicos | ||
| Nombre comercial |
Marcas Dostinex®,
Cabaser® Sogilen® | |
| Cat. embarazo | No hay estudios en humanos. El fármaco solo debe utilizarse cuando los beneficios potenciales justifican los posibles riesgos para el feto. Queda a criterio del médico tratante. (EUA) | |
| Estado legal | Solo Rx | |
| Vías de adm. | Oral | |
También se une a los receptores D2 del cuerpo estriado imitando las acciones de la dopamina en el control motor[5].
Historia editar
La cabergolina fue desarrollada por investigadores de la compañía italiana Farmitalia-Carbo Spa en Milán entre los años 1981 y 1982, quienes experimentaron con alcaloides derivados del ergot. Su desarrollo se basó en la estructura química y las propiedades farmacológicas de un compuesto anterior llamado ergotamina. La ergotamina se deriva de un hongo parásito conocido como Claviceps purpurea, que infecta variedad de hierbas y cereales, especialmente los granos del centeno[6].
Descripción editar
Derivada del ergot, es un agonista dopaminérgico con acción en receptores tipo D2. Se prescribe en casos de hiperprolactinemia fisiológica para interrumpir la lactancia en pacientes que no puedan o tengan contraindicaciones para alimentar al recién nacido[7]; o patológica, como puede ser la presencia de adenomas hipofisarios secretores de prolactina (micro y macroprolactinomas), hiperprolactinemia idiopática o síndrome de la silla turca vacía asociado con hiperprolactinemia. También está indicada en acromegalia, en combinación con análogos de la somatostatina para disminuir la secreción y producción de la hormona de crecimiento y del factor de crecimiento similar a la insulina Tipo 1 (IGF-1).[3][4]
Farmacocinética editar
Vías de administración editar
La cabergolina se administra vía oral y se debe ingerir con alimentos debido a que mejora la tolerancia gástrica[8].
Absorción editar
La cabergolina se disuelve en el medio ácido del jugo gástrico y la mayor parte de su absorción ocurre en el yeyuno e íleon. Alcanza las máximas concentraciones entre 2 - 3 horas y posteriormente se encuentra niveles en plasma que oscilan entre los 40 y 70 ug/mL[9].
Distribución editar
Experimentalmente, se estimó que la cabergolina se une a proteínas plasmáticas en un 41 - 42% [9] a concentraciones de 0,1-10 ng/mL. La cabergolina atraviesa la barrera hematoencefálica a través de una combinación de mecanismos como la difusión debido a que es una molécula pequeña y lipofílica, lo que permite el paso a través de la membrana. El paso a través de la BHE permite que pueda tener efectos en la enfermedad de Parkinson
La biodisponibilidad de la cabergolina es desconocida[8].
Metabolismo y metabolitos editar
La cabergolina se metaboliza en el hígado con una mínima participación de la enzima CYP3A4, la cual hace parte del sistema de enzimas del citocromo P450. Una fracción significativa de la dosis administrada sufre efecto de primer paso.
La principal ruta de biotransformación de la cabergolina se representa mediante la hidrólisis del enlace acilurea, lo cual produce el derivado ácido 8′β-carboxy ergolina, metabolito que durante las primeras 24 horas después de la dosis es encontrado en orina. A partir del metabolismo oxidativo se conduce la pérdida del grupo 3-dimetilaminopropil[10].
Excreción editar
La vida media de eliminación oscila entre 63 - 68 horas en pacientes sanos y entre 72 - 115 horas en pacientes con hiperprolactinemia[11].
Se elimina un 2 - 3% de la dosis en orina cómo fármaco sin cambios. Los metabolitos se eliminan en un 72% en heces y el 18% - 22% en orina. Siendo, el 6-alil-8β-carboxi-ergolina el principal metabolito identificado en orina y representa el 4 - 6%[12] de la dosis, además, se han identificado 3 metabolitos adicionales con menor actividad.
Farmacodinámica editar
Hormona relacionada - Prolactina editar
Factores estimuladores[13][14]:
- La succión del lactante es el estímulo fisiológico más potente para la liberación de prolactina y oxitocina mediante una vía nerviosa aferente en médula espinal que inhibe la secreción de dopamina y aumenta la producción de endorfinas lo cual lleva a una disminución en la secreción de dopamina en el hipotálamo, que a su vez disminuye la inhibición de la secreción de prolactina.
- El estímulo de la hormona liberadora de tirotropina (TRH) incrementa la sensibilidad de las células lactotropas en hipófisis y disminuye la sensibilidad a la inhibición por la dopamina.
- El estímulo de receptores opioides genera una supresión de la actividad de las neuronas TIDA dopaminérgicas, lo cual aumenta la secreción de prolactina en hipófisis.
- La vasopresina (ADH) secretada por los núcleos paraventricular y supraóptico favorecen la secreción de prolactina.
Factores inhibidores editar
La dopamina (catecolamina) secretada por neuronas dopaminérgicas del periventrículo y el núcleo arcuado del hipotálamo a través del tallo hipotálamo - hipófisis representa el principal inhibidor fisiológico de la secreción y síntesis de prolactina al interactuar con receptores de tipo D2 en células lactotropas de la adenohipófisis, lo que desencadena una cascada de señalización que inhibe la entrada de calcio, hiperpolariza la membrana celular y disminuye la secreción de prolactina, además, inhibe la adenilato ciclasa lo cual conduce a la restricción de la expresión del gen de la prolactina.
La prolactina también participa en la regulación de su secreción al actuar sobre el hipotálamo donde estimula la síntesis de dopamina[15].
La prolactina actúa sobre diferentes tejidos, principalmente en glándulas mamarias dónde se relaciona con su crecimiento y desarrollo, además de iniciar y mantener la secreción durante la lactancia; en ovarios retrasa la ovulación y los ciclos menstruales normales al disminuir la secreción de GnRH desde el hipotálamo, y en testículos las concentraciones plasmáticas o locales disminuyen la testosterona[16]. Una desregulación en la secreción de prolactina que aumenta sus concentraciones plasmáticas tiene implicaciones directas sobre los tejidos mencionados provocando galactorrea, amenorrea, anovulación, y azoospermia, por lo cual la hiperprolactinemia es la causa más frecuente de infertilidad secundaria.
Hormona relacionada - Hormona de crecimiento editar
La hormona de crecimiento (GH) es una hormona peptídica sintetizada por las células somatótropas en la hipófisis anterior, siendo fundamental en la regulación endocrina del crecimiento. Esta hormona tiene una secreción pulsátil y es estimulada por la hormona liberadora de hormona de crecimiento (GHRH) y la grelina. Por otro lado, la secreción de la hormona de crecimiento se encuentra inhibida por la somatostatina, un neuropéptido producido en el hipotálamo y que tiene efecto inhibitorio sobre las células somatótropas de la adenohipófisis[13].
En pacientes con hipersecreción de hormona de crecimiento (GH) ocasionado por un adenoma hipofisiario se expresan receptores dopaminérgicos, especialmente receptores D2 que cumplen una función inhibitoria sobre la secreción de hormona de crecimiento[3]. Esta inhibición de la secreción de la GH conlleva también a una disminución de las concentraciones del factor de crecimiento similar a la insulina tipo I (IGF-1) producido por las células diana de la GH. La función inhibitoria de la dopamina a través del receptor D2 sobre la secreción de hormona de crecimiento se ve complementada por la somatostatina, llegando a formar heterodímeros entre este receptor dopaminérgico y el receptor tipo 5 de somatostatina (SSTR5) que crean un receptor nuevo con una actividad funcional mejorada[17].
La hormona de crecimiento actúa sobre diferentes tejidos, especialmente sobre el músculo, tejido adiposo, hígado y huesos. Tiene efectos metabólicos como estimular la lipólisis, inhibir la captación de glucosa en el músculo y estimular la gluconeogénesis en hígado. Por otro lado, promueve el crecimiento tisular a través de la producción la IGF-1 a nivel periférico regulando los procesos de crecimiento y de composición corporal[13]. Un exceso en la secreción de hormona de crecimiento durante la infancia genera gigantismo, una deficiencia de esta hormona durante la infancia conlleva a un enanismo hipofisario.
Por otro lado, un exceso de hormona de crecimiento después de la pubertad produce acromegalia, síndrome que ocurre la mayoría de veces por un adenoma hipofisiario de células somatótropas secretoras de hormona de crecimiento. Los individuos con esta enfermedad presentan rasgos faciales típicos (frente, nariz y mejillas prominentes, labios gruesos, dientes muy separados y macroglosia), organomegalia y riesgo aumentado de enfermedades asociados a un exceso de hormona de crecimiento como por ejemplo hipertensión arterial, hipertrofia ventricular, falla cardíaca, apena obstructiva del sueño, cáncer de colon, diabetes mellitus tipo II, resistencia a la insulina y oligomenorrea, entre otros[18].
Mecanismo de acción editar
La cabergolina, al ser agonista directo del receptor D2 en las células lactotropas, inhibe la adenil ciclasa, lo cual disminuye las concentraciones de AMPc intracelular asociado con la disminución de la excitabilidad celular. Inhibe la fosfolipasa C que impide la liberación de Calcio (dependiente de IP3 de los depósitos intracelulares) y aumenta la conductancia de canales de potasio. La inhibición de la fosfolipasa C disminuye a su vez el diacilglicerol (DAG) el cual disminuye la actividad de proteína kinasa C, que mediante los efectos sobre AMPc y Calcio tiene la capacidad de modular los niveles de mRNA de la prolactina y la hormona de crecimiento[19].
Efectos farmacológicos editar
Interacciones[20] editar
| Fármacos que interactúan con Cabergolina | |
|---|---|
| Fármacos | Resultados de la interacción |
| Agonistas parciales del receptor D2 | Farmacodinámica: genera un antagonismo competitivo entre esta clase de fármacos, por lo tanto va a disminuir el efecto terapéutico. |
| Simpaticomiméticos (isometepteno mucato y fenilpropanolamina) | Farmacodinámica: genera una sinergia entre estos fármacos y la cabergolina. Hay reportes aislados de poderse generar hipertensión severa con dolores de cabeza entre simpaticomiméticos y agonistas D2 (bromocriptina y cabergolina). |
| Antagonistas del receptor D2 | Farmacodinámica: genera un antagonismo competitivo entre estos fármacos. La metoclopramida puede disminuir los efectos de la cabergolina. |
Uso clínico editar
Indicación editar
Se considera como tratamiento de elección para hiperprolactinemia y cuando se busca disminuir la galactorrea, la disfunción gonadal y el efecto masa cuando hay tumor, de forma que se controla a los pacientes sintomáticamente y puede disminuir los tamaños de los adenomas en el 90% de los casos[21].
La cabergolina ha sido empleada en ensayos clínicos como monoterapia en acromegalia, llegando a normalizar las concentraciones de IGF-1 y de conseguir concentraciones inferiores a 2.5 ng/ml de hormona de crecimiento. La cabergolina como monoterapia para la acromegalia se recomienda en pacientes con concentraciones al límite o moderadamente incrementadas de IGF-1 (<1.5 X la concentración máxima normal de IGF-1)[3]. La cabergolina es mayormente empleada en combinación con análogos de la somatostatina como lanreotida y Ocreotida[4]. Cuando se evidencia resistencia a estos medicamentos o falla terapéutica con los análogos de la somatostatina para normalizar niveles de IGF-1.
Este medicamento es utilizado para las mujeres quedar embarazadas rápidamente ya que baja la prolactina a un nivel de 0.00 además de que si tienes falta de menstruación por meses o un año o anovulacion vuelves a menstruar fácilmente. Este es el uso real del medicamento. No se usa para nada más.
Efectos adversos[11] editar
| Reacciones adversas en Cabergolina | ||
|---|---|---|
| Sistema implicado | Grupo CIOSM | Tipo de reacción |
| Sistema cardíaco | Poco frecuentes | Valvulopatías (incluye regurgitación) |
| Frecuencia no conocida | Palpitaciones | |
| Sistema respiratorio | Poco frecuentes | Disnea, derrame pleural, fibrosis, epistaxis |
| Muy raros | Fibrosis pleural | |
| Sistema inmunológico | Poco frecuentes | Reacción de hipersensibilidad |
| Sistema nervioso | Muy frecuente | Dolor de cabeza, mareos/vértigo |
| Frecuente | Somnolencia | |
| Poco frecuente | Síncope y parestesia | |
| Frecuencia no conocida | Inicio repentino de sueño, temblores | |
| Sistema nervioso Autonómo | Frecuente | Depresión |
| Poco frecuente | Aumento de la libido | |
| Frecuencia no conocida | Agresión, delirios, hipersexualidad, ludopatía, psicosis, alucinaciones | |
| Sistema vascular | Frecuente | Hipotensión con tratamiento a largo plazo, hipotensión postural y sofocos |
| Sistema gastrointestinal | Muy frecuentes | Náuseas, dispepsia, gastritis, dolor abdominal |
| Frecuentes | Estreñimiento, vómitos | |
Contraindicaciones editar
Se recomienda ajustar la dosis en personas con insuficiencia hepática categoría C de la clasificación de Child Pugh[20]. Este medicamento ha demostrado ser seguro en embarazo y hasta el momento no hay evidencia que sugiera un riesgo aumentado de anomalías congénitas ni de abortos espontáneos, pues estudios en mujeres que quedaron en embarazo durante el tratamiento con cabergolina muestran estadísticas similares a embarazadas no expuestas al medicamento en relación con eventos como abortos espontáneos y anomalías congénitas[22].Dentro de las categorías farmacológicas en embarazo según la FDA, la cabergolina puede clasificarse como categoría B, sin evidencia de riesgo sobre el feto.
Precauciones:
Este medicamento produce un fuerte e intenso dolor de espalda alta y baja el cual te lleva a acudir a urgencias. Este efecto es grave dejar de tomarlo de inmediato.
Sobredosis editar
No se ha estimado una dosis límite para Cabergolina debido a que ésta puede variar dependiendo del objetivo terapéutico. No obstante, se debe tener en cuenta que es un fármaco de vida media larga y las dosis semanales comprenden un rango de 0.25 mg - 0.5 mg, de esta forma, una sobredosificación puede sobre estimular los receptores de dopamina y derivar en la presentación de síntomas cómo:
- Náuseas
- Vómitos
- Hipotensión postural
- Confusión
- Psicosis/alucinaciones
Actualmente no se encuentra establecida una dosis de cabergolina que pueda ser letal.[12]
Presentaciones editar
Este fármaco está disponible en forma de comprimidos o tabletas que contienen 0,5 mg de cabergolina. Dentro de los excipientes con efecto conocido que contiene este medicamento se encuentra la lactosa[10], por lo cual debe tener precaución al administrarlo en pacientes con intolerancia a lactosa y deficiencia de enzimas relacionadas con el metabolismo de la lactosa y la galactosa. El comprimido puede dividirse en dosis iguales. Se recomienda conservar el medicamento a temperaturas inferiores a 30°[10], sin embargo, esto puede modificarse dependiendo del fabricante.
Controversias editar
Medicamentos para la profilaxis de la migraña como la ergotamina y la metisergida, supresores del apetito como la fenfluramina y agonistas dopaminérgicos derivados del ergot como la pergolida y la cabergolina se han relacionado con enfermedad valvular cardíaca fibrótica[23] por su actividad sobre el receptor serotoninérgico 5-HT2B presente en las válvulas cardiacas, el cual tras su activación y a través de quinasas de la familia Src promueven la mitogénesis de fibroblastos que incrementa la producción de matriz extracelular (fibrosis)[24].
Zanettini y cols reportaron que la presencia de regurgitación valvular moderada y severa era significativamente más prevalente en pacientes que recibían cabergolina (28,6%) en comparación con controles (5,6%). También, Schade y cols encontraron que la tasa de regurgitación valvular era mayor en pacientes que tomaban cabergolina, sugiriendo que había un riesgo incrementado en pacientes con dosis mayores de 3 mg diarios por más de 6 meses[25].
Debido a estos hallazgos, en julio del 2011 la FDA sugirió la realización de ecocardiogramas cada 6 o 12 meses en pacientes bajo tratamiento con cabergolina. Por otro lado en 2011, la Sociedad de Endocrinología en sus guías de manejo para la hiperprolactinemia estableció que el ecocardiograma solo era necesario para pacientes en tratamiento con altas dosis de cabergolina. Para aquellos bajo un tratamiento menor a 2 mg por semana no era necesario el ecocardiograma[26].
Debido a esta controversia, múltiples estudios se han llevado a cabo en torno a la asociación entre la enfermedad cardíaca valvular y la cabergolina en pacientes con prolactinomas. Caputo, Prior e Inder[26] en 2014 realizaron una revisión sistémica que recogió datos desde agosto de 1960 y julio de 2014 para establecer la prevalencia de casos confirmados de valvulopatías asociadas a cabergolina. A partir de todos los estudios se encontraron casos de regurgitación tricuspídea, sin embargo, los cambios morfológicos asociados a ésta no están relacionados a la cabergolina. Por otro lado, encontraron 2 casos confirmados de valvulopatía por cabergolina en 2 reportes de casos y 1 posible caso confirmado de este en un estudio de casos.
A partir de los datos clínicos recogidos en esta revisión sistemática se tuvieron en cuenta 1811 pacientes con prolactinoma en tratamiento con cabergolina, de los cuales se toman 3 casos de valvulopatía confirmada referente a 2 reportes de casos y 1 posible caso, por lo cual se establece una prevalencia de 0,17% (3/1811) de valvulopatías en pacientes con prolactinoma en tratamiento de cabergolina, prevalencia muy baja y que propone seguridad en el medicamento en su uso para la hiperprolactinemia. En 18 de 21 estudios analizados dentro de los cuales se incluyen estudios de casos y controles, estudios de cohortes prospectivos y retrospectivos y estudios transversales, no se encontraron valvulopatías asociadas a cabergolina[26].
Referencias editar
- ↑ Bases farmacológicas de la terapéutica. McGraw-Hill Interamericana. 2012.
- ↑ «Trastornos de la prolactina». www.intramed.net. Consultado el 11 de julio de 2023.
- ↑ a b c d Kuhn, Emmanuelle; Chanson, Philippe (2017-02). «Cabergoline in acromegaly». Pituitary (en inglés) 20 (1): 121-128. ISSN 1386-341X. doi:10.1007/s11102-016-0782-6. Consultado el 11 de julio de 2023.
- ↑ a b c Corica, Giuliana; Ceraudo, Marco; Campana, Claudia; Nista, Federica; Cocchiara, Francesco; Boschetti, Mara; Zona, Gianluigi; Criminelli, Diego et al. (5 de mayo de 2020). «Octreotide-Resistant Acromegaly: Challenges and Solutions». Therapeutics and Clinical Risk Management (en inglés) 16: 379-391. PMC 7211320. PMID 32440136. doi:10.2147/TCRM.S183360. Consultado el 11 de julio de 2023.
- ↑ «NCI Thesaurus». ncit.nci.nih.gov. Consultado el 11 de julio de 2023.
- ↑ Estrada-Bellmann, Ingrid; Cámara-Lemarroy, Carlos; Delgado-García, Guillermo; Cerda-Contreras, Christopher (1 de mayo de 2018). «Historical context of dopaminergic agonists». Revista Mexicana de Neurociencia 19 (3): 74-84. ISSN 1665-5044. doi:10.31190/rmn.2018.19.3.74.84. Consultado el 11 de julio de 2023.
- ↑ Moreno, B.; Obiols, G.; Páramo, C.; Zugasti, A. (2005-01). «Guía clínica del manejo del prolactinoma y otros estados de hiperprolactinemia». Endocrinología y Nutrición 52 (1): 9-17. ISSN 1575-0922. doi:10.1016/s1575-0922(05)70971-2. Consultado el 11 de julio de 2023.
- ↑ a b Del Dotto, Paolo; Bonuccelli, Ubaldo (2003). «Clinical Pharmacokinetics of Cabergoline:». Clinical Pharmacokinetics (en inglés) 42 (7): 633-645. ISSN 0312-5963. doi:10.2165/00003088-200342070-00003. Consultado el 11 de julio de 2023.
- ↑ a b Tulloch, Karen J; Dodin, Philippe; Tremblay‐Racine, Fannie; Elwood, Chelsea; Money, Deborah; Boucoiran, Isabelle (2019-06). «Cabergoline: a review of its use in the inhibition of lactation for women living with HIV». Journal of the International AIDS Society (en inglés) 22 (6). ISSN 1758-2652. PMC 6558502. PMID 31183987. doi:10.1002/jia2.25322. Consultado el 11 de julio de 2023.
- ↑ a b c «.:: CIMA ::. FICHA TECNICA CABERGOLINA TEVA 0,5 mg COMPRIMIDOS EFG». cima.aemps.es. Consultado el 11 de julio de 2023.
- ↑ a b Pfizer (2021). «Dostinex 0.5 mg (Cabergolina)».
- ↑ a b PubChem. «Cabergoline». pubchem.ncbi.nlm.nih.gov (en inglés). Consultado el 11 de julio de 2023.
- ↑ a b c Boron, Walter F. Fisiología médica (3 edición).
- ↑ «Prolactina, hormona, función, tipos, ¿qué es la prolactina? - Biología - 2023». svayambhava. Consultado el 11 de julio de 2023.
- ↑ Martín Pérez, Jorge (2020). «Fisiología de la prolactina». Fisiología humana (5 edición). McGraw Hill.
- ↑ Freeman, Marc E.; Kanyicska, Béla; Lerant, Anna; Nagy, György (10 de enero de 2000). «Prolactin: Structure, Function, and Regulation of Secretion». Physiological Reviews (en inglés) 80 (4): 1523-1631. ISSN 0031-9333. doi:10.1152/physrev.2000.80.4.1523. Consultado el 11 de julio de 2023.
- ↑ Rocheville, Magalie; Lange, Daniela C.; Kumar, Ujendra; Patel, Shutish C.; Patel, Ramesh C.; Patel, Yogesh C. (7 de abril de 2000). «Receptors for Dopamine and Somatostatin: Formation of Hetero-Oligomers with Enhanced Functional Activity». Science (en inglés) 288 (5463): 154-157. ISSN 0036-8075. doi:10.1126/science.288.5463.154. Consultado el 11 de julio de 2023.
- ↑ Ershadinia, Nazanin; Tritos, Nicholas A. (2022-02). «Diagnosis and Treatment of Acromegaly: An Update». Mayo Clinic Proceedings (en inglés) 97 (2): 333-346. doi:10.1016/j.mayocp.2021.11.007. Consultado el 11 de julio de 2023.
- ↑ Liu, X., Tang, C., Wen, G., Zhong, C., Yang, J., Zhu, J. y Ma, C. (2018). «El mecanismo y las vías de la dopamina y los agonistas de la dopamina en los prolactinomas.».
- ↑ a b The complete drug reference (38 edición). p. 899.
- ↑ Henao, Diana Cristina; Rojas, William (24 de marzo de 2017). «Manejo de pacientes con diagnóstico de adenoma hipofisario productor de prolactina. Experiencia del Hospital San José». Revista Colombiana de Endocrinología, Diabetes & Metabolismo 1 (1): 20-26. ISSN 2805-5853. doi:10.53853/encr.1.1.57. Consultado el 11 de julio de 2023.
- ↑ Stalldecker, Graciela; Mallea-Gil, María Susana; Guitelman, Mirtha; Alfieri, Analía; Ballarino, María Carolina; Boero, Laura; Chervin, Alberto; Danilowicz, Karina et al. (2010-12). «Effects of cabergoline on pregnancy and embryo-fetal development: retrospective study on 103 pregnancies and a review of the literature». Pituitary (en inglés) 13 (4): 345-350. ISSN 1386-341X. doi:10.1007/s11102-010-0243-6. Consultado el 11 de julio de 2023.
- ↑ Bhattacharyya, Sanjeev; Schapira, Anthony H; Mikhailidis, Dimitri P; Davar, Joseph (2009-08). «Drug-induced fibrotic valvular heart disease». The Lancet (en inglés) 374 (9689): 577-585. doi:10.1016/S0140-6736(09)60252-X. Consultado el 11 de julio de 2023.
- ↑ Córdoba-Soriano, Juan G.; Lamas-Oliveira, Cristina; Hidalgo-Olivares, Víctor M.; Tercero-Martínez, Antonia; Barambio-Ruíz, Moisés; Salas-Nieto, Jesús (2013-05). «Valvular Heart Disease in Hyperprolactinemic Patients Treated With Low Doses of Cabergoline». Revista Española de Cardiología (English Edition) (en inglés) 66 (5): 410-412. doi:10.1016/j.rec.2012.10.016. Consultado el 11 de julio de 2023.
- ↑ Devin, Jessica K.; Lakhani, Vipul T.; Byrd, Benjamin F.; Blevins, Lewis S. (2008-09). «Prevalence of Valvular Heart Disease in A Cohort of Patients Taking Cabergoline for Management of Hyperprolactinemia». Endocrine Practice (en inglés) 14 (6): 672-677. doi:10.4158/EP.14.6.672. Consultado el 11 de julio de 2023.
- ↑ a b c Caputo, Carmela; Prior, David; Inder, Warrick J (2015-11). «The need for annual echocardiography to detect cabergoline-associated valvulopathy in patients with prolactinoma: a systematic review and additional clinical data». The Lancet Diabetes & Endocrinology (en inglés) 3 (11): 906-913. doi:10.1016/S2213-8587(14)70212-8. Consultado el 11 de julio de 2023.