Tetracianoetileno
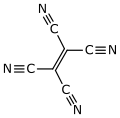
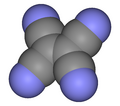
El tetracianoetileno, abreviado TCNE (TetraCiaNoEtileno), también llamado etenotetracarbonitrilo (nombre de la IUPAC), es un compuesto orgánico higroscópico de color claro que tiene una estructura planar. Formalmente es un etileno al que se le han sustituido los átomos de hidrógeno por grupos ciano.
| Tetracianoetileno | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Etenotetracarbonitrilo | ||
| General | ||
| Otros nombres |
TCNE Tetracianoetileno | |
| Fórmula estructural |
 | |
| Fórmula molecular | C6N4 | |
| Identificadores | ||
| Número CAS | 670-54-2[1] | |
| ChEMBL | CHEMBL3188794 | |
| ChemSpider | 12114 | |
| PubChem | 12635 | |
| Propiedades físicas | ||
| Densidad | 1350 kg/m³; 1,35 g/cm³ | |
| Masa molar | 12 809 g/mol | |
| Punto de fusión | 199 °C (472 K) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Síntesis y reactividad editar
Tetracianoetileno se prepara mediante bromación de malononitrilo en presencia de bromuro de potasio (KBr) para formar un complejo, que se deshalogena con polvo de cobre y calor.[2][3]
La oxidación de tetracianoetileno con peróxido de hidrógeno conduce al epóxido correspondiente que tiene propiedades químicas inusuales.[4]
En algunas reacciones de cicloadición se emplea el tetracianoetileno debido a que los 4 grupos ciano retiran densidad electrónica del doble enlace haciéndolo electrófilo facilitando así la reactividad:[5]
Química redox editar
El TCNE se utiliza a menudo como un aceptor de electrones. Los grupos ciano tienen orbitales π* de baja energía, y la presencia de cuatro de dichos grupos, con sus sistemas π ligados (conjugados) al doble enlace central C=C, da lugar a una excelente aceptor de electrones. Por lo tanto, el tratamiento de TCNE con sales de yoduro da el anión radical:
Debido a su planaridad y su capacidad para aceptar electrones, el TCNE se ha utilizado para preparar numerosos superconductores orgánicos. Tales sales de transferencia de carga a veces se llaman sales Bechgaard.
Precauciones de seguridad editar
El TCNE se hidroliza en disolución acuosa, en agua o con aire húmedo para dar cianuro de hidrógeno, por lo que debe manejarse con ciertas precauciones.[3]
Referencias editar
- ↑ Número CAS
- ↑ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals, 14. Auflage, 2006, ISBN 978-0-911910-00-1, S. 1582.
- ↑ a b R. A. Carboni (1959). «Tetracyanoethylene». Org. Synth. 39 (4): 64. doi:10.15227/orgsyn.039.0064.
- ↑ W. J. Linn (1969). «Tetracyanoethylene Oxide». Org. Synth. 49 (5): 103. doi:10.15227/orgsyn.049.0103.
- ↑ J. K. Williams , D. W. Wiley , B. C. McKusick (1962). «Cyanocarbon Chemistry. XIX.1,2 Tetracyanocyclobutanes from Tetracyanoethylene and Electron-rich Alkenes». J. Am. Chem. Soc. 84 (11): 2210-2215. doi:10.1021/ja00870a037.