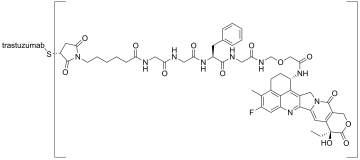
Trastuzumab deruxtecán
Trastuzumab deruxtecán es un fármaco inmunoconjugado indicado en el tratamiento del cáncer de mama.[1][2] Su uso médico fue aprobado en Estados Unidos en diciembre de 2019, en Japón en marzo de 2020,[3] en la Unión Europea en enero de 2021 y en Australia en octubre de 2021. Se comercializa con el nombre Enhertu.
| Trastuzumab deruxtecán | ||
|---|---|---|
 | ||
| Identificadores | ||
| Número CAS | 1826843-81-5 | |
| Código ATC | L01FD04 | |
| PubChem | 384585505 | |
| DrugBank | DB14962 | |
| ChEMBL | 4297844 | |
| Datos químicos | ||
| Fórmula | C6460H9972N1724O2014S44.(C52H57F1N9O13)8 | |
| Datos clínicos | ||
| Estado legal | Necesita prescripción médica | |
| Vías de adm. | Intravenoso | |
Indicaciones editar
Está indicado en pacientes afectos de cáncer de mama HER-2 positivo que no puede extirparse mediante intervención quirúrgica o presenta metástasis.[4]
Mecanismo de acción editar
El medicamento está formado por dos sustancias activas enlazadas:[5][6]
- Trastuzumab. Es un anticuerpo monoclonal que se une específicamente a la proteína HER2 que se expresa en la superficie de las células cancerosas.
- Deruxtecán. Es un citostático, bloquea la enzima topoisomerasa I, impidiendo de esta forma la replicación del ADN celular y dificultando la multiplicación de las células cancerosas.
Vía de administración editar
Se administra por vía intravenosa cada tres semanas durante un periodo de tiempo variable, dependiendo de la respuesta del paciente.
Efectos secundarios editar
Los efectos secundarios más frecuentes son: náuseas, vómitos, diarrea, estreñimiento, astenia, alopecia, anemia, neutropenia, leucopenia, trombocitopenia, tos y cefalea. Otros efectos secundarios son disminución de la fracción de eyección del ventrículo izquierdo del corazón y enfermedad pulmonar intersticial. Puede causar daños en el feto si se administra a mujeres embarazadas.[2][7]
Véase también editar
Referencias editar
- ↑ «Enhertu EPAR». European Medicines Agency (EMA). 9 de diciembre de 2020. Archivado desde el original el 23 de marzo de 2021. Consultado el 31 de marzo de 2021.
- ↑ a b European Medicines Agency.
- ↑ «Enhertu Approved in Japan for Treatment of Patients with HER2 Positive Unresectable or Metastatic Breast Cancer». Daiichi Sankyo. 25 de marzo de 2020. Archivado desde el original el 28 de enero de 2021. Consultado el 21 de enero de 2021 – via Business Wire.
- ↑ «FDA approves new treatment option for patients with HER2-positive breast cancer who have progressed on available therapies». U.S.Food and Drug Administration (FDA). 20 de diciembre de 2019. Archivado desde el original el 20 de diciembre de 2019. Consultado el 20 de diciembre de 2019.
- ↑ «Un caballo de Troya farmacológico optimiza la terapia contra el cáncer de mama más agresivo». Agencia SINC. Consultado el 25 de marzo de 2022.
- ↑ Javier Cortés; Sung-Bae Kim; Wei-Pang Chung; Seock-Ah Im, et al. (2022). «Trastuzumab Deruxtecan versus Trastuzumab Emtansine for Breast Cancer». N Engl J Med 386: 1143-1154. doi:10.1056/NEJMoa2115022. Consultado el 25 de marzo de 2022.
- ↑ Ficha técnica. Consultado el 20 de diciembre de 2022.