Ácido hiponitroso
El ácido hiponitroso es un compuesto químico con la fórmula HNO. Puede formularse como HON=NOH siendo un isómero de la nitramida, (H2N−NO2). Forma cristales blancos que son explosivos en estado seco.[2] Hay dos posibles estructuras, trans y cis, y el sólido se cree que es la forma trans.[2]
| Ácido hiponitroso | ||
|---|---|---|
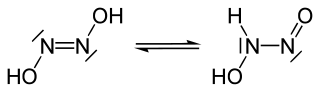 | ||
 | ||
| Nombre IUPAC | ||
| Ácido monoxonítrico (III) | ||
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 14448-38-5[1] | |
| ChEBI | 14428 | |
| ChemSpider | 55636 | |
| PubChem | 135398676, 135476779, 135496072 61744, 135398676, 135476779, 135496072 | |
| KEGG | C01818 | |
| Propiedades físicas | ||
| Masa molar | 62,011627 g/mol | |
El ácido hiponitroso es un ácido débil (pk1 = 7.21, pK2= 11.54) en disolución acuosa y se descompone a N2O y agua con una vida media de 16 días a 25 °C a un pH ácido de 1-3.[2]
- H2N2O2 → H2O + N2O
Como esta reacción no es reversible, el N2O no debería ser considerado como el anhídrido del H2N2O2.[2]
El ácido hiponitroso forma dos series de sales, los "hiponitritos" que contienen aniones [HON=NO]− y los hiponitritos que contienen el anión [ON=NO]2−.[2]
El ácido puede prepararse a partir de hiponitrito de plata y HCl anhidro en éter:
- Ag2N2O2 + 2HCl → H2N2O2 + 2AgCl
El hiponitrito de plata puede prepararse por la reducción del nitrito de sodio:[3]
- 2NaNO2 + 4Na/Hg + 2H2O + 2AgNO3 → Ag2N2O2 + 2NaNO3 + 4NaOH + 4Hg
Reacción con el cuerpo humano
editarEl ácido hiponitroso, al ser una sustancia química con propiedades particulares, puede tener efectos adversos significativos al contacto con el cuerpo humano. Aquí te detallo cómo puede afectar el contacto con esta sustancia:
Contacto con la piel: El ácido hiponitroso puede causar irritación en la piel. Al entrar en contacto, puede provocar enrojecimiento, dolor y posible formación de ampollas. La exposición prolongada o repetida puede llevar a dermatitis o quemaduras químicas.
Contacto con los ojos: La exposición del ácido hiponitroso a los ojos puede causar irritación severa, enrojecimiento, dolor intenso y daño potencial a la córnea. Es crucial enjuagar los ojos con abundante agua y buscar atención médica inmediata en caso de contacto.
Inhalación: La inhalación de vapores o aerosoles de ácido hiponitroso puede irritar las vías respiratorias. Los síntomas pueden incluir tos, dificultad para respirar y dolor en el pecho. En exposiciones graves, puede provocar edema pulmonar, una condición médica urgente.
Ingestión: La ingestión de ácido hiponitroso puede causar dolor abdominal severo, náuseas, vómitos y daño al tracto gastrointestinal. La ingestión accidental debe ser tratada de inmediato en un centro médico.
Efectos crónicos: La exposición prolongada al ácido hiponitroso, especialmente en ambientes industriales sin protección adecuada, puede resultar en problemas respiratorios crónicos y daños en la piel.
Precauciones de manejo: Debido a estos riesgos, es fundamental utilizar equipo de protección personal adecuado, como guantes, gafas protectoras y respiradores. Además, el ácido hiponitroso debe manejarse en áreas bien ventiladas y bajo estrictas normas de seguridad para minimizar los riesgos para la salud.
Aplicaciones y Propiedades del Ácido Hiponitroso
editarEl ácido hiponitroso es un ácido químico utilizado en diversas aplicaciones industriales debido a sus propiedades únicas. Entre las aplicaciones más comunes se encuentran:
Formación de cristales blancos: El ácido hiponitroso puede formar cristales blancos que son explosivos en estado seco. Estos cristales tienen una estructura específica, siendo generalmente la forma trans la más común.
Producción de hiponitritos: Este ácido forma dos series de sales, conocidas como hiponitritos, que contienen los aniones [HON=NO]− y [ON=NO]2−. Estos hiponitritos son importantes en varias reacciones químicas.
Reacciones químicas en disolución acuosa: El ácido hiponitroso es un ácido débil (pK₁ = 7.21, pK₂= 11.54) y se descompone en N₂O y agua con una vida media de 16 días a 25 °C a un pH ácido de 1-3. Esta reacción no es reversible, por lo que el N₂O no debe considerarse como el anhídrido del H₂N₂O₂.
Preparación a partir de hiponitrito de plata: El ácido hiponitroso se puede preparar mediante la reacción del hiponitrito de plata con HCl anhidro en éter, resultando en la formación de H₂N₂O₂ y AgCl.
El ácido hiponitroso, con su fórmula química H₂N₂O₂, presenta propiedades y aplicaciones industriales específicas que lo hacen un componente esencial en ciertos procesos químicos. Es fundamental manejarlo con cuidado debido a su naturaleza explosiva y sus posibles efectos sobre la salud y el medio ambiente.
Referencias
editar- ↑ Número CAS
- ↑ a b c d e Egon Wiberg, Arnold Frederick Holleman (2001) Inorganic Chemistry, Elsevier ISBN 0-12-352651-5
- ↑ Greenwood, Norman N.; Earnshaw, A. (1997). Chemistry of the Elements (2ª edición). Oxford: Butterworth-Heinemann. ISBN 0080379419.
Enlaces externos
editar- Esta obra contiene una traducción derivada de «Hyponitrous acid» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.