ARN interferente
El ARN interferente o ARN de interferencia (abreviado como ARNi), es una molécula de ARN que suprime la expresión de genes específicos mediante mecanismos conocidos globalmente como ribointerferencia o interferencia por ARN (RNA interference, RNAi).
Tipos de ARN interferente
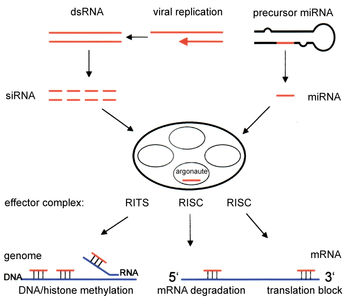
editarLos ARN interferentes son moléculas pequeñas (de 20 a 25 nucleótidos) que se generan por fragmentación de precursores más largos. Se pueden clasificar en tres grandes grupos de moléculas:[2]
siRNA
editarEl acrónimo siRNA proviene del inglés small interfering RNA: en español, ARN interferente pequeño. Son moléculas de ARN bicatenario perfectamente complementarias de aproximadamente 20 o 21 nucleótidos (nt) con 2 nucleótidos desemparejados en cada extremo 3'. Cada hebra de ARN tiene un grupo fosfato 5' y un grupo hidroxilo (-OH) 3'. Esta estructura proviene del procesamiento llevado a cabo por Dicer, una enzima que corta moléculas largas de ARN bicatenario (dsRNA, double stranded RNA) en varios siRNA.[3] Una de las hebras del siRNA (la hebra 'antisentido') se ensambla en un complejo proteico denominado RISC (RNA-induced silencing complex), que utiliza la hebra de siRNA como guía para identificar el ARN mensajero complementario. El complejo RISC cataliza el corte del ARNm complementario en dos mitades, que son degradadas por la maquinaria celular, bloqueando así la expresión del gen. Los siRNA pueden ser también introducidos de forma exógena en las células utilizando métodos de transfección basándose en la secuencia complementaria de un gen en particular, con la finalidad de reducir significativamente su expresión.
Micro-ARN
editarLos micro-ARN (en inglés, micro-RNA o miRNA) son pequeños ARN interferentes que se generan a partir de precursores específicos codificados en el genoma, que al transcribirse se pliegan en horquillas (hairpins) intramoleculares que contienen segmentos de complementariedad imperfecta. El procesamiento de los precursores ocurre generalmente en dos etapas, catalizado por dos enzimas, Drosha en el núcleo y Dicer en el citoplasma. Una de las hebras del miRNA (la hebra 'antisentido'), como ocurre con los siRNA, se incorpora a un complejo similar al RISC. Dependiendo del grado de complementariedad del miRNA con el ARNm, los miRNA pueden bien inhibir la traducción del ARNm o bien inducir su degradación. Sin embargo, a diferencia con la vía de los siRNA, la degradación de ARNm mediada por miRNA se inicia con la eliminación enzimática de la cola de poli(A) del ARNm.
piRNA
editar(Piwi-interacting RNAs, ARN asociados a Piwi[4]): se generan a partir de precursores largos monocatenarios, en un proceso que es independiente de Drosha y Dicer. Estos ARN pequeños se asocian con una subfamilia de las proteínas 'Argonauta' denominada proteínas Piwi. Se han identificado decenas de miles de piRNA, pero su función es desconocida (2008). Sin embargo, se sabe que conjuntamente con las proteínas Piwi, son necesarios para el desarrollo de las células de la línea germinal.
Variación entre organismos
editarLos organismos varían en su capacidad de aceptar ARN bicatenario extraño y utilizarlo en la ruta de RNAi. Los efectos de la ribointerferencia pueden ser sistémicos y heredables en plantas y C. elegans, pero no en Drosophila o mamíferos. En plantas, se piensa que la ribointerferencia se propaga por la transferencia de siRNA entre las células, a través de los plasmodesmos (canales en las paredes celulares que permiten la comunicación y el transporte). La heredabilidad procede de la metilación de los promotores dirigida por RNA interferente; el nuevo patrón de metilación se copia en cada nueva generación de la célula.[6]
Entre plantas y animales se observa una distinción general amplia en la utilización de los miRNA endógenos; en plantas, los miRNA son normalmente perfectamente (o casi) complementarios a su gen diana, e inducen el corte directo del ARN a través de RISC, mientras que los miRNA de animales tienden a ser más divergentes en la secuencia e inducen represión a nivel de la traducción del ARNm diana.[5]
ARN interferentes y pseudogenes
editarEn 2008, varios estudios en moscas[7][8][9][10] y en ratones,[11][12] proporcionan nueva información: en estos estudios, se sugiere una conexión entre RNAi y pseudogenes que hace más difusa la distinción "tradicional" en tres clases de pequeños ARN: siRNA, miRNA y piRNA (ver un resumen en Sasidharan et al., Nature 2008[13]).
La definición clásica de pseudogén es un elemento genético heredable que es similar a un gen, pero que es afuncional. Sin embargo, el término "afuncional" es ambiguo: ¿significa que no se transcribe, que no se traduce o que no está bajo el control de un promotor?. Los pseudogenes son similares a genes que codifican proteínas porque normalmente se han generado por copia de un gen ancestral, bien por duplicación incorrecta o por retrotransposición (en la que el ADN es primero transcrito en ARN y luego "retro-transcrito" en ADN e insertado en otro lugar del genoma). Como el proceso de copiado no genera una proteína funcional, los pseudogenes se identifican por 'disfunciones' en su secuencia, como cambios de marco de lectura (frameshifts), o paradas prematuras. Son interesantes porque constituyen un resto de antiguas moléculas codificadas por el genoma.
Los pseudogenes son por tanto fósiles de genes de antiguas proteínas, y aunque muchos de ellos se transcriben, se han considerado como ADN basura, que constituye en su conjunto alrededor del 99 % del genoma en humanos. Una gran parte del ADN «basura» está constituido precisamente por pseudogenes; esta abundancia de pseudogenes en el genoma (decenas de miles en humanos, casi la misma cantidad de genes que codifican proteínas) hace improbable que sean afuncionales. Además, una gran parte de ellos están sometidos a un proceso de selección natural.[14] Una de las funciones propuesta para los pseudogenes es la regulación génica, y el mecanismo propuesto para realizar esta función es el RNAi.
Los seis manuscritos indicados anteriormente describen el descubrimiento de pequeñas moléculas de siRNA naturales en moscas y en ratones, algunas de las cuales son potencialmente transcritas a partir de pseudogenes.
Endo-siRNA
editarEn general, el proceso de ARNi implica varios tipos de pequeñas secuencias de ARN «guía» que regulan los niveles de la proteína diana al direccionar para su degradación el ARNm de esta. En los seis estudios indicados, algunos siRNA procedentes de pseudogenes generan dos de las cuatro categorías de siRNA naturales (o endo-siRNA):
- la primera categoría de endo-siRNA media el silenciamiento de transposones, que es una característica de los piRNA. A diferencia de los piRNA, que constan de 24 a 30 nucleótidos y utilizan Piwi como proteína efectora, los endo-siRNA de primera categoría tienen de 21 a 22 nt, y utlilizan Ago2.
- la segunda categoría se genera mediante la transcripción bidireccional de loci parcialmente superpuestos en hebras opuestas de ADN.[7][10] Se han identificado unos 1000 endo-siRNA de este tipo en moscas, y estudios en ratones muestran algunos ejemplos.[11][12] Los genes diana de esta categoría de endo-siRNA están relacionados con funciones de los ácidos nucleicos, como actividad nucleasa o unión a factores de transcripción.
- la tercera categoría de endo-siRNA se ha detectado solo en ratones[11][12] y son el producto de la interacción de un ARNm transcrito a partir de un gen que codifica una proteína y un transcrito anti-sentido a partir del pseudogén correspondiente, que puede estar localizado lejos del gen codificante, en el mismo cromosoma o en otro.
- los endo-siRNA de la cuarta categoría están muy relacionados con los de la tercera: se generan a partir de secuencias en forma de horquilla (hairpin), que en ratón pueden proceder de las estructuras en repetición invertida de los pseudogenes. En este caso, el pseudogén también regula su gen codificante, pero el precursor de ARN bicatenario procede de la transcripción de una secuencia con repeticiones invertidas que dan lugar a una horquilla.
Los manuscritos indicados muestran que las proteínas de ratón afectadas por las categorías tercera y cuarta de endo-siRNA están generalmente implicadas en funciones específicas —como la regulación de la dinámica del citoesqueleto— lo que indica que la regulación subyacente mediada por pseudogenes ha sido seleccionada expresamente para ello, y no generada simplemente por el apareamiento al azar de tránscritos de genes y pseudogenes.
También se han encontrado precursores en horquilla de endo-siRNA en moscas, pero hay pocas evidencias que los relacionen con pseudogenes. La mayor parte de los endo-siRNA asociados con pseudogenes, por tanto, se han detectado en ratones. Una posible explicación es que el genoma de ratón contiene muchos más pseudogenes que el genoma de la mosca.[15]
Sin embargo, para demostrar de forma concluyente la actividad de los pseudogenes, son necesarios más experimentos (por ejemplo, eliminar un pseudogén y demostrar el efecto sobre el gen codificante potencialmente regulado por el pseudogén).
Como se indicaba al principio, además de conectar pseudogenes y ARNi, estos estudios también hacen más difusas las diferencias entre los tres tipos «tradicionales» de ARN interferentes (siRNA, miRNA y piRNA), que son distintos en su biogénesis y en sus funciones celulares. Estos estudios indican que los endo-siRNA regulan transposones (como los piRNA), que pueden generarse a partir de estructuras en horquilla (como los miRNA) y que, en moscas, su procesamiento implica un cofactor similar al de los miRNA.
El hecho de que las líneas de separación entre los distintos tipos de ARN interferente sean más difusas, unido a las nuevas conexiones entre pseudogenes y siRNA, tiene interesantes consecuencias evolutivas. En plantas se ha propuesto que las duplicaciones invertidas de un gen codificante podrían ser un mecanismo de generación de nuevos miRNA.[16] De esta forma, algunos endo-siRNA codificados por pseudogenes podrían proporcionar una conexión intermedia para comprender la evolución de la regulación génica mediada por miRNA.[17] Aunque especulativa, un estudio reciente del contexto genómico de más de 300 miRNA loci en humanos ha identificado dos en pseudogenes,[18] lo que apoyaría dicha hipótesis.
Inmunidad Mediada por ARNi
editarEl ARN de interferencia es una parte vital de la respuesta inmune a los virus y otros materiales genéticos diferentes a los del mismo organismo, especialmente en plantas, donde posiblemente previene la propagación de transposomas.
Plantas como Arabidopsis thaliana expresan múltiples cortadores homólogos que se especializan en reaccionar de maneras diferentes cuando la planta se expone a diferentes tipos de virus. Aún antes de que la síntesis de ARNi fuera completamente comprendida, ya se sabía que la inducción del silenciamiento de genes en plantas se daba de manera sistémica y podía ser transferido de una planta a otra por medio de injertos. Se reconoce dicho fenómeno desde que se descubrió como un mecanismo de la planta del Sistema Inmunne Innato, y permite por completo a la planta responder a los virus después de su localización.
En respuesta a este mecanismo muchos virus de plantas han desarrollado mecanismo que suprimen la respuesta del ARNi, que incluyen proteínas virales que unen fragmentos cortos de ARN de doble cadena con fragmentos de cadena simple, eliminando los ARN virales. Algunos genomas de plantas expresan iARNs en respuesta a infecciones por tipos específicos de bacterias. Dichos efectos pueden ser parte de una respuesta generalizada que disminuye cualquier proceso metabólico en el huésped para disminuir el impacto de la infección.
Aunque los animales generalmente expresan algunas otras variantes de enzimas cortadoras a diferencia de las plantas, el ARNi en algunos animales ha demostrado tener respuesta antivírica. Tanto en la Drosophila juvenil como en la adulta, el ARNi es un importante antiviral del sistema inmune innato y está activo contra patógenos como el Virus X de Drosophila. Un rol similar de inmunidad puede operar en el Caenorhabditis elegans como proteínas argonautas que son hiperreguladas en respuesta a virus y gusanos que sobre-expresan componentes de la síntesis de ARNi, por lo que son resistentes a infecciones virales.
El rol del ARNi en la inmunidad innata de mamíferos es pobremente comprendido, y hay poca información disponible. De cualquier manera, la existencia de virus que codifican genes capaces de suprimir la respuesta ARNi en células de mamíferos funciona como evidencia de sistemas inmunitarios ARNi-dependientes en mamíferos. Funciones alternativas de ARNi en virus de mamíferos existe también como miARN expresados por el virus del Herpes, que probablemente actúe como un disparador de la organización de heterocromatina para medir su latencia viral.
Aplicación del ARNi en la terapia génica
editarEl ARNi es un método para el silenciamiento de genes que puede ser aplicado en la terapia génica, con posibles aplicaciones en patologías como cáncer, infecciones víricas y enfermedades neurodegenerativas y oculares. En el cáncer el blanco de ARNi son los oncogenes vinculados a la patología. Los objetivos de la terapia en el cáncer serían tres: ARNi para genes que forman parte de vías celulares vinculadas con el cáncer, para genes que participan en las interacciones tumor-huésped y para genes que están involucrados en la resistencia a quimioterapia y radioterapia. Para el caso de las infecciones virales el ARNi inhibe la expresión de genes virales, que interrumpen la replicación viral, causando la interrupción del ciclo de vida viral o bien el cese del mismo. En los desórdenes neurodegenerativos, la aplicación de los ARNi sería dirigirlos a las secuencias específicas causantes de la enfermedad, algunas de las enfermedades que pueden ser tratadas son: Enfermedad de Huntington, Enfermedad de Parkinson, ataxías y Enfermedad de Alzheimer. Para el caso de los síndromes oculares los ARNi pueden ser usados para infusiones intraoculares.[19][20] Un caso de uso de ARNi es en el estudio del gusano pantera de tres bandas, para poder determinar a través de este método que genes se están expresando, por inhibición de su funcionalidad.[21]
Véase también
editarReferencias
editar- ↑ Hammond, S. M.; Bernstein, E.; Beach, D.; Hannon, G. J. (16 de marzo de 2000). «An RNA-directed nuclease mediates post-transcriptional gene silencing in Drosophila cells». Nature 404 (6775): 293-296. ISSN 0028-0836. PMID 10749213. doi:10.1038/35005107. Consultado el 15 de marzo de 2023.
- ↑ Grosshans, Helge; Filipowicz, Witold (24 de enero de 2008). «Molecular biology: the expanding world of small RNAs». Nature 451 (7177): 414-416. ISSN 1476-4687. PMID 18216846. doi:10.1038/451414a. Consultado el 15 de marzo de 2023.
- ↑ Bernstein, E.; Caudy, A. A.; Hammond, S. M.; Hannon, G. J. (18 de enero de 2001). «Role for a bidentate ribonuclease in the initiation step of RNA interference». Nature 409 (6818): 363-366. ISSN 0028-0836. PMID 11201747. doi:10.1038/35053110. Consultado el 15 de marzo de 2023.
- ↑ Hartig, Julia Verena; Tomari, Yukihide; Förstemann, Klaus (15 de julio de 2007). «piRNAs--the ancient hunters of genome invaders». Genes & Development 21 (14): 1707-1713. ISSN 0890-9369. PMID 17639076. doi:10.1101/gad.1567007. Consultado el 15 de marzo de 2023.
- ↑ a b Saumet, Anne; Lecellier, Charles-Henri (12 de enero de 2006). «Anti-viral RNA silencing: do we look like plants?». Retrovirology 3: 3. ISSN 1742-4690. PMC 1363733. PMID 16409629. doi:10.1186/1742-4690-3-3. Consultado el 15 de marzo de 2023.
- ↑ Jones, L.; Ratcliff, F.; Baulcombe, D. C. (15 de mayo de 2001). «RNA-directed transcriptional gene silencing in plants can be inherited independently of the RNA trigger and requires Met1 for maintenance». Current biology: CB 11 (10): 747-757. ISSN 0960-9822. PMID 11378384. doi:10.1016/s0960-9822(01)00226-3. Consultado el 15 de marzo de 2023.
- ↑ a b Czech, Benjamin; Malone, Colin D.; Zhou, Rui; Stark, Alexander; Schlingeheyde, Catherine; Dus, Monica; Perrimon, Norbert; Kellis, Manolis et al. (Junio de 2008). «An endogenous small interfering RNA pathway in Drosophila». Nature (en inglés) 453 (7196): 798-802. ISSN 1476-4687. doi:10.1038/nature07007. Consultado el 15 de marzo de 2023.
- ↑ Ghildiyal, Megha; Seitz, Hervé; Horwich, Michael D.; Li, Chengjian; Du, Tingting; Lee, Soohyun; Xu, Jia; Kittler, Ellen L. W. et al. (23 de mayo de 2008). «Endogenous siRNAs derived from transposons and mRNAs in Drosophila somatic cells». Science (New York, N.Y.) 320 (5879): 1077-1081. ISSN 1095-9203. PMC 2953241. PMID 18403677. doi:10.1126/science.1157396. Consultado el 15 de marzo de 2023.
- ↑ Kawamura, Yoshinori; Saito, Kuniaki; Kin, Taishin; Ono, Yukiteru; Asai, Kiyoshi; Sunohara, Takafumi; Okada, Tomoko N.; Siomi, Mikiko C. et al. (5 de junio de 2008). «Drosophila endogenous small RNAs bind to Argonaute 2 in somatic cells». Nature 453 (7196): 793-797. ISSN 1476-4687. PMID 18463636. doi:10.1038/nature06938. Consultado el 15 de marzo de 2023.
- ↑ a b Okamura, Katsutomo; Chung, Wei-Jen; Ruby, J. Graham; Guo, Huili; Bartel, David P.; Lai, Eric C. (5 de junio de 2008). «The Drosophila hairpin RNA pathway generates endogenous short interfering RNAs». Nature 453 (7196): 803-806. ISSN 1476-4687. PMC 2735555. PMID 18463630. doi:10.1038/nature07015. Consultado el 15 de marzo de 2023.
- ↑ a b c Tam, Oliver H.; Aravin, Alexei A.; Stein, Paula; Girard, Angelique; Murchison, Elizabeth P.; Cheloufi, Sihem; Hodges, Emily; Anger, Martin et al. (22 de mayo de 2008). «Pseudogene-derived small interfering RNAs regulate gene expression in mouse oocytes». Nature 453 (7194): 534-538. ISSN 1476-4687. PMC 2981145. PMID 18404147. doi:10.1038/nature06904. Consultado el 15 de marzo de 2023.
- ↑ a b c Watanabe, Toshiaki; Totoki, Yasushi; Toyoda, Atsushi; Kaneda, Masahiro; Kuramochi-Miyagawa, Satomi; Obata, Yayoi; Chiba, Hatsune; Kohara, Yuji et al. (22 de mayo de 2008). «Endogenous siRNAs from naturally formed dsRNAs regulate transcripts in mouse oocytes». Nature 453 (7194): 539-543. ISSN 1476-4687. PMID 18404146. doi:10.1038/nature06908. Consultado el 15 de marzo de 2023.
- ↑ Sasidharan, Rajkumar; Gerstein, Mark (5 de junio de 2008). «Genomics: protein fossils live on as RNA». Nature 453 (7196): 729-731. ISSN 1476-4687. PMID 18528383. doi:10.1038/453729a. Consultado el 15 de marzo de 2023.
- ↑ Zheng, Deyou; Frankish, Adam; Baertsch, Robert; Kapranov, Philipp; Reymond, Alexandre; Choo, Siew Woh; Lu, Yontao; Denoeud, France et al. (Junio de 2007). «Pseudogenes in the ENCODE regions: consensus annotation, analysis of transcription, and evolution». Genome Research 17 (6): 839-851. ISSN 1088-9051. PMC 1891343. PMID 17568002. doi:10.1101/gr.5586307. Consultado el 15 de marzo de 2023.
- ↑ Harrison, Paul M.; Milburn, Duncan; Zhang, Zhaolei; Bertone, Paul; Gerstein, Mark (1 de febrero de 2003). «Identification of pseudogenes in the Drosophila melanogaster genome». Nucleic Acids Research 31 (3): 1033-1037. ISSN 1362-4962. PMC 149191. PMID 12560500. doi:10.1093/nar/gkg169. Consultado el 15 de marzo de 2023.
- ↑ Allen, Edwards; Xie, Zhixin; Gustafson, Adam M.; Sung, Gi-Ho; Spatafora, Joseph W.; Carrington, James C. (Diciembre de 2004). «Evolution of microRNA genes by inverted duplication of target gene sequences in Arabidopsis thaliana». Nature Genetics 36 (12): 1282-1290. ISSN 1061-4036. PMID 15565108. doi:10.1038/ng1478. Consultado el 15 de marzo de 2023.
- ↑ Chapman, Elisabeth J.; Carrington, James C. (Noviembre de 2007). «Specialization and evolution of endogenous small RNA pathways». Nature Reviews. Genetics 8 (11): 884-896. ISSN 1471-0064. PMID 17943195. doi:10.1038/nrg2179. Consultado el 15 de marzo de 2023.
- ↑ Devor, Eric J. (2006). «Primate microRNAs miR-220 and miR-492 lie within processed pseudogenes». The Journal of Heredity 97 (2): 186-190. ISSN 0022-1503. PMID 16489141. doi:10.1093/jhered/esj022. Consultado el 15 de marzo de 2023.
- ↑ Grimm, Dirk; Kay, Mark A. (2007). «RNAi and gene therapy: a mutual attraction». Hematology. American Society of Hematology. Education Program: 473-481. ISSN 1520-4391. PMID 18024667. doi:10.1182/asheducation-2007.1.473. Consultado el 15 de marzo de 2023.
- ↑ Morales Sánchez, Rosario Andrea (Enero de 2010). «Terapia génica con RNA de interferencia» (PDF). Universidad Veracruzana. Facultad de Ciencias Químicas. Archivado desde el original el 20 de febrero de 2019. Consultado el 15 de marzo de 2023.
- ↑ Gehrke, Andrew R.; Neverett, Emily; Luo, Yi-Jyun; Brandt, Alexander; Ricci, Lorenzo; Hulett, Ryan E.; Gompers, Annika; Ruby, J. Graham et al. (15 de marzo de 2019). «Acoel genome reveals the regulatory landscape of whole-body regeneration». Science (en inglés) 363 (6432). ISSN 0036-8075. PMID 30872491. doi:10.1126/science.aau6173. Consultado el 23 de enero de 2020.
Enlaces externos
editar- Wikiversidad alberga proyectos de aprendizaje sobre ARN interferente.
- Animación del proceso de RNAi (en inglés), de Nature
- NOVA scienceNOW explains RNAi – Un video de 15 minutos (en inglés) del magacín Nova que se emitió en PBS, July 26, 2005
- Silencing Genomes Experimentos de RNAi y bioinformática en C. elegans para alumnos. Del Dolan DNA Learning Center of Cold Spring Harbor Laboratory (en inglés).
- RNAi screens in C. elegans in a 96-well liquid format and their application to the systematic identification of genetic interactions (a protocol)
- 2 American ‘Worm People’ Win Nobel for RNA Work, from NY Times
- Nano RNA Delivery - Novel delivery agents could mean a more targeted way to turn off disease genes, Technology Review, April 29, 2008