Atalureno
Atalureno es un medicamento indicado en el tratamiento de la enfermedad de Duchenne.[1] En 2014 la Agencia Europea del Medicamento le concedió una autorización condicional, a la espera de obtener más datos sobre su eficacia y seguridad.[2] Sin embargo en febrero de 2016, la FDA de Estados Unidos rechazó la solicitud de aprobación del fármaco, el laboratorio fabricante apeló la decisión y la FDA volvió a rechazarla en octubre de 2016. Por este motivo atalureno está disponible en varios países de la Unión Europea, pero no en Estados Unidos.[3]
 | ||
 | ||
| Identificadores | ||
|---|---|---|
| Número CAS | 775304-57-9 | |
| Código ATC | M09AX03 | |
| PubChem | 11219835 | |
| DrugBank | DB05016 | |
| ChEBI | 94805 | |
| ChEMBL | 256997 | |
| Datos químicos | ||
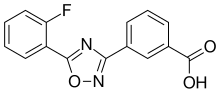
| Fórmula | C15H9N2FO3 | |
| Datos clínicos | ||
| Vías de adm. | Oral | |
Indicaciones
editarEstá indicado en el tratamiento de pacientes mayores de 2 años con capacidad de deambulación, diagnosticados de distrofia muscular de Duchenne que presenten una mutación sin sentido en el gen que codifica la distrofina.[1][4]
Mecanismo de acción
editarAlgunos pacientes afectos de distrofia muscular de Duchenne presentan un tipo específico de mutación (mutación sin sentido) en el gen que codifica la distrofina, de tal forma que se produce una parada prematura en el proceso de traducción y en consecuencia no se genera la proteína distrofina completa y funcional, lo que provoca la enfermedad. El atalureno facilita de alguna forma el proceso de lectura ribosómica del ARNm, haciendo posible la producción de distrofina funcional.[1]
Efectos secundarios
editarLos efectos secundarios más frecuentes, que afectan a más del 5% de los pacientes, son: náuseas, vómitos, diarrea, dolor de cabeza, dolor en la región superior del abdomen y flatulencia.[2]
Atalureno y fibrosis quística
editarSe han realizado ensayos clínicos para estudiar la utilidad del atalureno en el tratamiento de la fibrosis quística. El 2 de marzo de 2017 la compañía fabricante anunció la interrupción de los estudios por falta de eficacia. [5]
Referencias
editar- ↑ a b c Informe de Posicionamiento Terapéutico de atalureno (Translarna®) en el tratamiento de la distrofia muscular de Duchenne. Ministerio de Sanidad y Consumo, Agencia española de medicamentos y productos sanitarios. Fecha de publicación: 4 de mayo de 2017. Consultado el 29 de abril de 2023.
- ↑ a b European Medicines Agency. Información general sobre Translarna y sobre los motivos por los que se autoriza su uso en la UE.
- ↑ Pagliarulo, Ned (17 de octubre de 2016). «FDA snubs PTC appeal for Duchenne drug». BioPharma Dive.
- ↑ «Translarna - Summary of Product Characteristics» (en inglés). UK Electronic Medicines Compendium. 24 de abril de 2017. Consultado el 18 de junio de 2017.
- ↑ Drug Company Ends Ataluren Program for CF Nonsense Mutations. Cystic Fibrosis Foundation, publicado el 3 de marzo 2017.