Cloruro de niobio (V)
El cloruro de niobio (V), también conocido como pentacloruro de niobio, es un sólido cristalino de color amarillo. Se hidroliza en el aire y las muestras suelen estar contaminadas con pequeñas cantidades de NbOCl3. A menudo se utiliza como precursor de otros compuestos de niobio. El NbCl5 puede purificarse por sublimación.[2]
| Cloruro de niobio | ||
|---|---|---|
 | ||
 | ||
| General | ||
| Fórmula estructural |
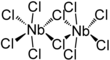 | |
| Fórmula molecular | NbCl5 | |
| Identificadores | ||
| Número CAS | 10026-12-7[1] | |
| Número RTECS | QU0350000 | |
| ChemSpider | 8374796 23203, 8374796 | |
| PubChem | 10199297 24818, 10199297 | |
| UNII | 9S1BC7865F | |
| Propiedades físicas | ||
| Masa molar | 267,7506415 g/mol | |
| Estructura cristalina | sistema trigonal | |
Estructura y propiedades
editarEl cloruro de niobio(V) forma dímeros clorobridados en estado sólido (véase la figura). Cada centro de niobio tiene seis coordenadas, pero la coordinación octaédrica está muy distorsionada. Las longitudes de los enlaces ecuatoriales niobio-cloro son de 225 pm (terminal) y 256 pm (puente), mientras que los enlaces axiales niobio-cloro son de 229,2 pm y están desviados hacia el interior para formar un ángulo de 83,7° con el plano ecuatorial de la molécula. El ángulo Nb-Cl-Nb en el puente es de 101,3°. La distancia Nb-Nb es de 398,8 pm, demasiado larga para cualquier interacción metal-metal.[3] NbBr5, TaCl5 y TaBr5 son isoestructurales con NbCl5, pero NbI5 y TaI5 tienen estructuras diferentes.
Preparación
editarIndustrialmente, el pentacloruro de niobio se obtiene por cloración directa del niobio metálico entre 300 y 350 °C:[4]
2 Nb + 5 Cl2 → 2 NbCl5
En el laboratorio, el pentacloruro de niobio se prepara a menudo a partir de Nb2O5, siendo el principal problema la reacción incompleta para dar NbOCl3. La conversión puede efectuarse con cloruro de tionilo:[5] También puede prepararse por cloración de pentóxido de niobio en presencia de carbono a 300 °C.
Usos
editarEl cloruro de niobio (V) es el principal precursor de los alcóxidos de niobio, que se utilizan en el procesamiento sol-gel. También es el precursor de muchos otros reactivos que contienen Nb, incluidos la mayoría de los compuestos organobianos.
En síntesis orgánica, el NbCl5 es un ácido de Lewis muy especializado en la activación de alquenos para la reacción carbonilo-eno y la reacción de Diels-Alder. El cloruro de niobio también puede generar compuestos de N-aciliminio a partir de ciertas pirrolidinas que son sustratos para nucleófilos como el aliltrimetilsilano, el indol o el éter silil enol de la benzofenona.[6]
Referencias
editar- ↑ Número CAS
- ↑ Cotton, F. Albert; Wilkinson, Geoffrey. Advanced Inorganic Chemistry (4th ed.). New York: Wiley,. ISBN 0-471-02775-8.
- ↑ Cotton, F.A., P. A. Kibala, M. Matusz and R. B. W. Sandor (1991). «Structure of the Second Polymorph of Niobium Pentachloride». Acta Crystallogr. C 47 (11): 2435-2437. doi:10.1107/S0108270191000239.
- ↑ Joachim Eckert, Hermann C. Starck (2005). «Niobium and Niobium Compounds». Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. ISBN 3527306730. doi:10.1002/14356007.a17_251.
- ↑ Brown, D. (1957). «Niobium(V) Chloride and Hexachloroniobates(V)». Inorganic Syntheses. Inorganic Syntheses 9. pp. 88-92. ISBN 9780470132401. doi:10.1002/9780470132401.ch24.
- ↑ Andrade, C. K. Z.; Rocha, R. O.; Russowsky, D.; Godoy, M. N. (2005). «Studies on the Niobium Pentachloride-Mediated Nucleophilic Additions to an Enantiopure Cyclic N-acyliminium Ion Derived from (S)-malic acid». J. Braz. Chem. Soc. 16 (3b): 535-539. doi:10.1590/S0103-50532005000400007.
Enlaces externos
editar- Safety information from ChemExper
- NIST Standard Reference Database
- Esta obra contiene una traducción derivada de «Niobium(V) chloride» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.