Reacción de Koch
La reacción de Koch es una reacción orgánica para la síntesis de ácidos carboxílicos terciarios a partir de alcoholes o alquenos . La reacción es una carbonilación fuertemente catalizada por ácidos utilizando monóxido de carbono, y normalmente se produce a altas presiones que oscilan entre 50 y 5.000 kPa, a menudo requieren temperaturas unos cientos de grados superiores a la temperatura ambiente. Generalmente la reacción se realiza con ácidos minerales fuertes como el ácido sulfúrico, HF o BF 3 .[1]
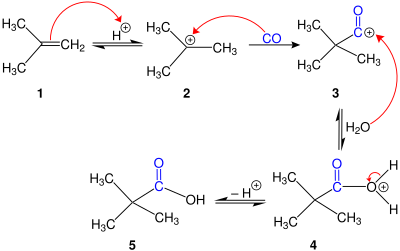
Mecanismo editar
Cuando se utilizan catalizadores ácidos estándar como el ácido sulfúrico o una mezcla de BF 3 y HF, el mecanismo[2] comienza por la protonación del alqueno, seguida del ataque de monóxido de carbono del carbocatión resultante. El catión acilio posterior se hidroliza en el ácido carboxílico terciario. Si el sustrato es un alcohol, se protona y, posteriormente, se elimina, generando un carbocatión que se convierte en catión acilio por el monóxido de carbono y después se hidroliza . La formación de carbocatión terciario es típicamente favorecida termodinámicamente cuando se consideran los desplazamientos de hidruro o alquilo en el carbocatión..
operaciones a gran escala para la industria química fina producen casi 150.000 toneladas de ácidos de Koch y sus derivados anualmente[3] pero también generan una gran cantidad de residuos, lo que motiva los intentos en curso de utilizar metales, ácidos sólidos y otros nuevos catalizadores para permitir el uso de condiciones de reacción más suaves. El ácido fórmico, que se descompone fácilmente en monóxido de carbono en presencia de ácidos o de calor relativamente bajo, se utiliza a menudo en lugar del monóxido de carbono directamente; este procedimiento se desarrolló poco después de la reacción de Koch y se llama más comúnmente la reacción de Koch-Haaf . Esta variación permite reacciones a temperatura y presión ambiente casi estándar . Algunos ácidos de producción industrial Koch habitual incluyen el ácido piválico, el ácido 2,2-dimetilbutírico y el ácido 2,2-dimetilpentanoico.
Uso y variaciones del catalizador editar
La aplicación industrial a gran escala de la reacción de Koch con fuertes ácidos minerales se complica por la corrosión de los equipos, los procedimientos de separación de los productos y la dificultad para gestionar grandes cantidades de ácidos residuales. Se han investigado diversas resinas ácidas[4][5] y líquidos iónicos ácidos[6] para descubrir si los ácidos de Koch se pueden sintetizar en entornos más suaves. Aunque el uso de líquidos iónicos ácidos para la reacción de Koch requiere temperaturas y presiones relativamente altas (8 MPa y 430 K en un estudio de 2006[6] ), las soluciones iónicas ácidas en sí se pueden reutilizar con sólo una ligera disminución del rendimiento, y las reacciones se pueden llevar a cabo de forma bifásica para garantizar una fácil separación de los productos. También se ha investigado un gran número de catalizadores de catalizadores de metales de transición para utilizarlos en reacciones similares a Koch: catalizadores de cationes de carbonilo Cu(I),[7] Au(I)[8] y Pd(I )[9] carbonilo disueltos en sulfúrico. el ácido puede permitir que la reacción progrese a temperatura ambiente y presión atmosférica. El uso de un catalizador de tetracarbonilo de níquel con CO y agua como nucleófilo se conoce como carbonilación de Reppe, y existen muchas variaciones de este tipo de carbonilación mediada por metales utilizados en la industria, especialmente los utilizados por Monsanto y los procesos Cativa, que convierten metanol . a ácido acético utilizando catalizadores ácidos y monóxido de carbono en presencia de catalizadores metálicos.
Productos secundarios editar
Las reacciones de Koch pueden acarrear un gran número de productos secundarios, aunque generalmente son posibles rendimientos elevados (Koch y Haaf informaron de rendimientos superiores al 80% para varios alcoholes en su artículo de 1958). Se observan reordenamientos de carbocations, eterización (en caso de que se utilice un alcohol como sustrato, en lugar de un alqué) y, ocasionalmente, los ácidos carboxílicos C N+1 del sustrato se observan a causa de la fragmentación y dimerización de los iones carbenio derivados del monóxido de carbono, sobre todo porque cada paso de la reacción es reversible.[10] También se sabe que los ácidos alquilsulfúricos son posibles productos secundarios, pero normalmente se eliminan por el exceso de ácido sulfúrico utilizado.
Aplicaciones editar
Las reacciones de tipo Koch-Haaf ven un uso extensivo en el diseño racional de fármacos[11][12] como una forma conveniente de generar ácidos carboxílicos terciarios cruciales. Empresas como Shell y ExxonMobil producen ácido piválico a partir de isobuteno mediante la reacción de Koch,[3] así como varios otros ácidos carboxílicos ramificados. Sin embargo, las reacciones de Koch-Haaf también se utilizan para la interrogación de varios otros temas. Dado que los reactivos se encuentran en diferentes fases, la reacción de Koch se ha utilizado para estudiar la cinética de reacciones de los sistemas gas-líquido-líquido, así como para consultar el uso de resinas ácidas sólidas y líquidos iónicos ácidos para reducir los residuos de subproductos peligrosos.
Referencias editar
- ↑ Koch, H.; Haaf, W. Ann. 1958, "618", 251–266.(doi 10.1002/jlac.19586180127)
- ↑ Li, J. J. In "Koch–Haaf carbonylation"; Name Reactions, 4th ed.; Springer, Berlin, 2009; p. 319. (doi 10.1007/978-3-642-01053-8_140)
- ↑ a b Weissermel, K., Jargen-Arpe, H. In "Syntheses involving carbon monoxide", Industrial Organic Chemistry; VCH Publishers: New York, NY; pp. 141–145. (ISBN 978-3527320028)
- ↑ Tsumori, N., Xu, Q., Souma, Y., Mori, H. J. Mol. Cat. A, 2002, 179, 271–77. (doi 10.1016/S1381-1169(01)00396-X)
- ↑ Xu, Q., Inoue, S., Tsumori, N., Mori, H., Kameda, M., Fujiwara, M., Souma, Y. J. Mol. Cat. A, 2001, 170, 147. (doi 10.1016/S1381-1169(01)00054-1)
- ↑ a b Qiao, K., Yokoyama, C. Cat. Comm. 2006, 7, 450–453. (doi 10.1016/j.catcom.2005.12.009)
- ↑ Souma, Y. Sano, H., Iyoda, J. J. Org. Chem., 1973, 38, 2016. (doi 10.1021/jo00951a010)
- ↑ Xu, Q., Imamura, Y., Fujiwara, M., Souma, Y. J. Org. Chem., 1997, 62, 1594–1598. (doi 10.1021/jo9620122)
- ↑ Xu, Q., Souma, Y. Top. Catal., 1998, 6, 17. (doi 10.1023/A:1019158221240)
- ↑ Stepanov, A. G., Luzgin, M. V., Romannikov, V. N., Zamaraev, K. I. J. Am. Chem. Soc., 1995, 117, 3615–16. (doi 10.1021/ja00117a032)
- ↑ Barton, V., Ward, S. A., Chadwick, J., Hill, A., O'Neill, P. M. J. Med. Chem., 2010, 53, 4555–59. (doi 10.1021/jm100201j)
- ↑ Brilman, D. W. F., van Swaaij, W. P. M., Versteeg, G. F. Chem. Eng. Sci., 1999, 54, 4801–09. (doi 10.1016/S0009-2509(99)00197-9)