Toxicidad por cobre
La toxicidad por cobre es un tipo envenenamiento por metales causado por un exceso de cobre en el cuerpo. También llamado Copperiedus puede ocurrir por comer alimentos ácidos cocinados en utensilios de cobre sin recubrir, o por la exposición a un exceso de cobre en el agua potable u otras fuentes medioambientales.
| Toxicidad por cobre | ||
|---|---|---|
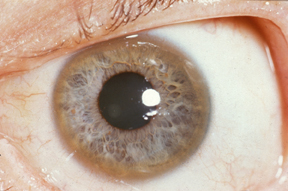 Un Anillo de Kayser-Fleischer, depósito de cobre encontrado en la córnea,, es una indicación de que el cuerpo no está metabolizando el cobre adecuadamente. | ||
| Especialidad | Toxicología | |
| Sinónimos | ||
| Copperiedus | ||
Señales y síntomas editar
Síntomas agudos de envenenamiento por cobre por ingestión incluye vomitar, hematemesis (vómito con sangre), hipotensión (baja presión de la sangre), melena (heces de color negro "alquitranado"), coma, ictericia (pigmentación amarillenta de la piel), y malestar gastrointestinal.[1] Individuos con deficiencia de glucosa-6-fostato pueden estar en un riesgo aumentado de contraer efectos hematológicos por cobre. La anemia hemolítica resultante del tratamiento de quemaduras con compuestos de cobre es infrecuente.
La exposición crónica (a largo plazo) al cobre puede dañar el hígado y los riñones.[2] Los mamíferos tienen mecanismos eficientes para regular las reservas de cobre, de tal manera que están generalmente protegidos del exceso de niveles de cobre en la dieta.[3]
Esos mismos mecanismos de protección pueden causar síntomas leves, los cuales a menudo son mal diagnosticados como desórdenes psiquiátricos. Hay mucha investigación en la función de la proporción Cu/Zn en condiciones neurológicas, endocrinológicas y fisiológicas.[4][5][6] Muchas de las sustancias que nos protegen de un exceso de cobre realizan funciones importantes en nuestros sistemas neurológicos y endocrinos, lo cual conduce a dificultades de diagnóstico. Cuando son usadas para enlazar cobre en el plasma y prevenir que sea absorbido en los tejidos, sus propias funciones pueden incumplirse. Tales síntomas a menudo incluyen cambios de humor, irritabilidad, depresión, fatiga, excitación, dificultad para concentrarse y sensación de estar fuera de control. Para complicar aún más el diagnóstico, algunos síntomas del exceso de cobre son similares a aquellos de una deficiencia de cobre.
El Nivel Máximo de Contaminantes (NMC) por la Agencia de Protección Ambiental de Estados Unidos (USEPA) en agua potable es de 1.3 miligramos por litro.[1][7] El NMC para cobre está basado en la expectativa del tiempo de una vida consumiendo cobre en el agua a este nivel sin efectos (gastrointestinales) adversos. La USEPA coloca al cobre como un micronutriente y una toxina.[8] La toxicidad en mamíferos incluye una amplia gama de animales y efectos como cirrosis hepática, necrosis en riñones y cerebro, afecciones gastrointestinales, lesiones, presión de sangre baja, y mortalidad fetal.[9][10][11] La Seguridad Ocupacional y Administración de Administración de Seguridad y Salud Ocupacional (OSHA) ha puesto un límite de 0.1 mg/m³ para humos de cobre (vapor generado de calentar cobre) y 1 mg/m³ para polvo de cobre (partículas metálicas finas de cobre) y nieblas (aerosol de cobre soluble) en aire de un sitio de trabajo durante un turno de ocho horas, semana laboral de 40 horas.[12] La toxicidad para otras especies de plantas y animales se observa en niveles variables.
Toxicidad editar
El cobre en la sangre y en el torrente sanguíneo existe en dos formas: vinculado a la ceruloplasmina (85@–95%), y el resto "libre", vagamente vinculado a la albúmina y moléculas pequeñas. Nutricionalmente, hay una diferencia distintiva entre cobre orgánico y cobre inorgánico, que es acorde si el ion de cobre esta vinculado a un ligando orgánico.[13][14]
Datos sobre cáncer de EPA editar
La EPA (USEPA) establece que no hay evidencia de incidencia para cáncer en humanos relacionada con el cobre y establece la evidencia encontrada en animales que relaciona cobre con cáncer como "inadecuada". Dos estudios en ratones no han mostrado ningún incremento en la incidencia de cáncer. Uno de ellos utilizó inyecciones regulares de compuestos de cobre, que incluyeron óxido de cobre. Un estudio de dos cepas de ratones alimentados con compuestos de cobre encontró un variable aumento en la incidencia de sarcoma en células reticulares en machos de una cepa, pero no en la otra cepa (hubo un ligero incremento en las hembras de ambas cepas) Esos resultados no se han replicado.[15]
Causa editar
Utensilios de cocina editar
Los utensilios de cocina en los cuales el cobre es el principal elemento estructural (en oposición a los revestimientos de cobre, cobre en su interior o de color cobre) es algunas veces fabricado sin un material que lo aísle cuando está destinado a ser usado en un número de tareas culinarias específicas, como la preparación de conservas o merengues. Existen por otra parte, utensilios de cocina hechos de cobre que están forrados con un metal no reactivo para prevenir el contacto entre alimentos ácidos y el elemento estructural de cobre de estos utensilios.
Excepto para condiciones agudas o crónicas, la exposición al cobre en elementos de cocina es generalmente considerada inofensiva.[16] Según Paracelso, la dosis hace al veneno; en lo que respecta al cobre "un mecanismo de defensa aparentemente ha evolucionado como consecuencia de lo cual la toxicidad en el hombre es muy inusual."[17]
Aguda y concurrente exposición al cobre es posible cuando se cocina o se guardan alimentos altamente ácidos en recipientes de cobre sin aislamiento por periodos prolongados de tiempo, o por exposición de productos alimenticios a las sales reactivas de cobre (corrosión de cobre, o verdigris). Continuas y pequeñas exposiciones ("crónicas") de alimentos ácidos al cobre pueden también resultar en toxicidad en casos donde, o bien el potencial de interacción con el área de superficie es significante, o el pH es excepcionalmente bajo y concentrado (en el caso de cocinar por ejemplo, con vinagre o vino), o ambos, y es insuficiente el tiempo que transcurre entre las exposiciones para la eliminación hemostática normal del exceso de cobre.
Se pueden observar excepciones a lo anteriormente descrito en el caso de las mermeladas, gelatinas y preparados de conservas, donde los recipientes de cobre sin revestir son usados para cocinar (no para almacenar) preparaciones ácidas, en este caso de frutas. Los métodos para hacer mermeladas y conservas especifican al azúcar como químicamente necesaria para la acción de preservación (antibacterial), que tiene el efecto adicional de mediar (amortiguar) la interacción de la fruta ácida con el cobre, permitiendo el uso del metal por sus eficientes propiedades de transferencia térmica.[18][19]
Herramientas antichispa editar
La OSHA ha determinado un conjunto de estándares de seguridad para el desbaste y afilado de herramientas hechas cobre y de aleaciones de cobre, que son usadas a menudo en aplicaciones que no producen chispas. Estos estándares se encuentran en el Código de Regulaciones Federales 29 CFR 1910.134 y 1910.1000.[20]
Nota: La más importante aleación de cobre que no produce chispa es el cobre al berilio, y que puede conducir al envenenamiento por berilio.
Agua potable editar
Con una dosis letal media DL50 de 30 mg/kg en ratas, cantidades tan pequeñas como un gramo de sulfato de cobre son potencialmente letales en humanos.[21] El nivel seguro sugerido de cobre en el agua potable para consumo humano varía dependiendo de la fuente, pero tiende a situarse en 1.3 mg/l.[22]
Control de natalidad editar
Hay condiciones en las cuales el metabolismo de cobre de un individuo se compromete de tal forma que se extiende más allá del control de natalidad lo cual puede causar un problema de acumulación de cobre. Éstos incluyen toxicidad o simplemente incremento de cobre desde otras fuentes, así como también incrementos (por vía de la placenta de la madre) en los niveles de cobre del individuo antes de su nacimiento.[23]
Fisiopatología editar
Una porción significativa de la toxicidad por cobre proviene su capacidad de aceptar y donar simples electrones cuando cambia su estado de oxidación. Esto cataliza la producción de iones radicales muy reactivos, tales como los radicales hidroxilo en una forma similar a la reacción de Fenton.[24] Esta actividad catalítica del cobre es utilizada por las enzimas con las que es asociado, así es únicamente tóxico cuando no está secuestrado ni mediado. Este incremento en radicales reactivos no mediados se denomina generalmente estrés oxidativo, y es una área activa de investigación en una variedad de enfermedades donde el cobre puede jugar un importante pero más sutil función que en la toxicidad aguda.
Algunos de los efectos del envejecimiento pueden estar asociados con un exceso de cobre.[25]
Cirrosis infantil india editar
Una manifestación de toxicidad por cobre, cirrosis hepática en niños (cirrosis infaltil india), ha sido vinculada con hervir leche en utensilios de cocina hechos de cobre. El Manual de Merck afirma que estudios recientes sugieren que un defecto genético está particularmente asociado con esta cirrosis.[26]
Enfermedad de Wilson editar
Una condición heredada llamada laenfermedad de Wilson causa que el cuerpo retenga cobre, ya que no es excretado por el hígado en la bilis. Esta enfermedad, si no es tratada, puede conducir a daños en el cerebro y el hígado. Ell tetratiomolibdato de bis-colina está bajo investigación como terapia contra la enfermedad de Wilson.
Enfermedad de Alzheimer editar
Niveles elevados de cobre libre existen en la enfermedad de Alzheimer, que ha sido hipotéticamente relacionado con el consumo de cobre inorgánico.[27][28] Se sabe que el cobre y el zinc se unen a proteínas beta amiloides en la enfermedad de Alzheimer.[29] Se cree que esta estructura unida participa en la producción de especies reactivas de oxígeno en el cerebro.[30]
Diagnóstico editar
ICD-9-CM código 985.8 Efecto tóxico de otros metales especificados incluye envenenamientos agudos y crónicos por cobre (u otros efectos tóxicos) ya sea intencional, accidental, industrial etc.
- Además, esto incluye envenenamientos y efectos tóxicos de otros metales que incluyen estaño, selenio, níquel, hierro, metales pesados, talio, plata, litio, cobalto, aluminio y bismuto. Algunos envenenamientos, p. ej. fosfuro de zinc, podría también estar incluido bajo 989.4 Envenenamiento debido a otro pesticidas, etc.
- Se excluyen los efectos tóxicos del mercurio, arsénico, manganeso, berilio, antimonio, cadmio, y cromo.
ICD-10-CM editar
| Código | Plazo |
|---|---|
| T56.4X1D | Efecto tóxico del cobre y sus compuestos, accidentales (involuntarios), contacto posterior. |
| T56.4X1S | Efecto tóxico de cobre y sus compuestos, accidentales (involuntarios), secuela |
| T56.4X2D | Efecto tóxico de cobre y sus compuestos, daño intencionado, contacto posterior |
| T56.4X2S | Efecto tóxico de cobre y sus compuestos, daño intencionado, secuela |
| T56.4X3D | Efecto tóxico de cobre y sus compuestos, agresión, contacto posterior |
| T56.4X3S | Efecto tóxico de cobre y sus compuestos, agresión, secuela |
| T56.4X4D | Efecto tóxico de cobre y sus compuestos, sin determinar, contacto posterior |
| T56.4X4S | Efecto tóxico del cobre y sus compuestos, sin determinar, secuela |
SNOMED editar
| Concepto ID | Término |
|---|---|
| 46655005 | Cobre |
| 43098002 | Fiebre de cobre |
| 49443005 | Envenenamiento crónico fitogénico por cobre |
| 50288007 | Envenenamiento crónico por cobre |
| 73475009 | Envenenamiento hepatogénico crónico por cobre |
| 875001 | Calcosis del ojo |
| 90632001 | Envenenamiento agudo por cobre |
Tratamiento editar
En casos de sospechas de envenenamiento por cobre, la penicilamina es el fármaco de elección, y el dimercaprol, un agente quelante de metales pesados, es a menudo administrado. No se recomienda dar vinagre, ya que ayuda a solubilizar las sales insolubles de cobre. Los síntomas inflamatorios deben ser tratados según principios generales, al igual que los nerviosos.
Hay cierta evidencia de que el ácido alfa-lipoico (ALA) puede actuar como un quelante del cobre unido a los tejidos.[31] El ácido alfa lipoico también está siendo investigado como quelante de otros metales pesados, como el mercurio.[32]
Vida acuática editar
Demasiado cobre en el agua puede dañar los organismos marinos y de agua dulce como peces y moluscos.[33] Las especies de peces varían en su sensibilidad al cobre, con la DL50 para 96-h de exposición al sulfato de cobre reportada en el orden de 58 mg por litro para tilapia (Oreochromis niloticus) y 70 mg por litro para pez gato (Clarias gariepinus).[34] El efecto crónico de concentraciones subletales de cobre en peces y en otras criaturas es el daño a las branquias, hígado, riñones y el sistema nervioso. También interfiere con el sentido del olfato en peces, impidiéndoles escoger buenos compañeros o de encontrar el camino a las áreas de apareamiento.[35]
Pintura con base en cobre es un agente antiincrustante marino común.[36] En los Estados Unidos, la pintura con base en cobre reemplazó al tributilo de estaño, el cual fue prohibido debido a su toxicidad, como una forma de control de crecimiento orgánico en los cascos de los barcos. En 2011, el estado de Washington se convierte en el primer estado de los EE. UU. en prohibir el uso de pinturas con base en cobre para embarcaciones, aunque solo aplica a botes recreacionales.[37] California ha perseguido también iniciativas para reducir el efecto de la lixiviación de cobre, con la USEPA aún en investigaciones.[38]
Bacterias editar
El cobre y sus aleaciones como el latón han sido encontradas tóxicas para las bacterias vía efecto oligodinámico. El mecanismo exacto de acción es desconocido, pero es común a otros metales pesados. Los virus son menos susceptibles a este efecto que las bacterias. Aplicaciones asociadas incluyen el uso de latón en pomos de puertas en hospitales, los cuales han sido encontrados auto desinfectados después de ocho horas, y en desinfectantes minerales en los cuales el cobre actúa como un algicida. Se ha especulado que el exceso en el uso de cobre como algicida causó la epidemia de envenenamiento por cobre en Isla Gran Palmera en 1979.[39]
Referencias editar
- ↑ a b Casarett & Doull's Toxicology, The Basic Science of Poisons, Fifth Edition, Edited by Curtis D. Klassen, Ph.D., McGraw-Hill, New York. pp 715.
- ↑ Copper: Health Information Summary, Environmental Fact Sheet. New Hampshire Department of Environmental Services, ARD-EHP-9 2005, Available Online at: http://des.nh.gov/organization/commissioner/pip/factsheets/ard/documents/ard-ehp-9.pdf
- ↑ Lutsenko, Svetlana; Barnes, Natalie L.; Bartee, Mee Y.; Dmitriev, Oleg Y. (2007). «Function and Regulation of Human Copper-Transporting ATPases». Physiological Reviews 87 (3): 1011-1046. PMID 17615395. doi:10.1152/physrev.00004.2006.
- ↑ Desai, Vishal; Kaler, Stephen G. (2008). «Role of copper in human neurological disorders». The American Journal of Clinical Nutrition 88 (3): 855S-858S. PMID 18779308. doi:10.1093/ajcn/88.3.855S. Consultado el 20 de diciembre de 2015.
- ↑ Kaplan, Bonnie J.; Crawford, Susan G.; Gardner, Beryl; Farrelly, Geraldine (2002). «Treatment of Mood Lability and Explosive Rage with Minerals and Vitamins: Two Case Studies in Children». Journal of Child and Adolescent Psychopharmacology 12 (3): 205-219. PMID 12427294. doi:10.1089/104454602760386897.
- ↑ Faber, Scott; Zinn, Gregory M.; Kern Ii, John C.; Skip Kingston, H. M. (2009). «The plasma zinc/serum copper ratio as a biomarker in children with autism spectrum disorders». Biomarkers 14 (3): 171-180. PMID 19280374. doi:10.1080/13547500902783747.
- ↑ Federal Register / Vol. 65, No. 8 / Wednesday, January 12, 2000 / Rules and Regulations. pp. 1976.
- ↑ US EPA Region 5 (28 de diciembre de 2011). «Ecological Toxicity Information». US EPA. Consultado el 17 de junio de 2015.
- ↑ «Toxicological Profile for Copper». Agency for Toxic Substances and Disease Registry, U.S. Department of Health and Human Services. Consultado el 17 de junio de 2015.
- ↑ Kabata-Pendias, Alina (2011). «Trace Elements in Soils and Plants, Fourth Edition». Taylor and Francis Group. Archivado desde el original el 16 de julio de 2015. Consultado el 17 de junio de 2015.
- ↑ Ware, George W. (1983). Pesticides: Theory and application. New York: W.H. Freeman. OCLC 669712126.
- ↑ Occupational Safety and Health Administration, U.S. Department of Labor, Copper, Available Online at: https://www.osha.gov/SLTC/metalsheavy/copper.html
- ↑ Batley, G. E., & Florence, T. M. (1976). Determination of the chemical forms of dissolved cadmium, lead and copper in seawater. Marine Chemistry, 4(4), 347-363.
- ↑ Van Den Berg, C. M. (1984). Organic and inorganic speciation of copper in the Irish Sea. Marine Chemistry, 14(3), 201-212.
- ↑ EPA results for copper and cancer. Accessed March 11, 2011
- ↑ «The Dispatch - Google News Archive Search».
- ↑ Sternlieb, Irmin (June 1967). «Gastrointestinal Copper Absorption in Man». Gastroenterology 52 (6): 1038-1041. doi:10.1016/S0016-5085(67)80160-4.
- ↑ «Jam Making 101: The Tools and Techniques for Success».
- ↑ Escoffier, Auguste; Gilbert, Pliléas (1961). Larousse Gastronomique. New York: Crown. p. 546.
- ↑ «Occupational Safety and Health Standards». Consultado el 18 de septiembre de 2012.
- ↑ «Pesticide Information Profile for Copper Sulfate». Cornell University. Consultado el 10 de julio de 2008.
- ↑ «The Water Supply (Water Quality) Regulations 2000».
- ↑ «Copper and iron transport across the placenta: regulation and interactions». Journal of Neuroendocrinology 20 (4): 427-31. 2008. PMID 18266949. doi:10.1111/j.1365-2826.2008.01658.x.
- ↑ Held KD (May 1996). «Role of Fenton chemistry in thiol-induced toxicity and apoptosis». Radiat. Res. 145 (5): 542-53. Bibcode:1996RadR..145..542H. PMID 8619019. doi:10.2307/3579272.
- ↑ Brewer GJ (February 2007). «Iron and copper toxicity in diseases of aging, particularly atherosclerosis and Alzheimer's disease». Exp. Biol. Med. (Maywood) 232 (2): 323-35. PMID 17259340.
- ↑ «Merck Manuals -- Online Medical Library: Copper». Merck. November 2005. Consultado el 19 de julio de 2008.
- ↑ Brewer GJ (Apr 2010). «Copper toxicity in the general population». Clin Neurophysiol 121 (4): 459-60. PMID 20071223. doi:10.1016/j.clinph.2009.12.015.
- ↑ Brewer GJ (June 2009). «The risk of copper toxicity contributing to cognitive decline in the aging population and to Alzheimer's disease». J. Am. Coll. Nutr. 28 (3): 238-42. PMID 20150596. doi:10.1080/07315724.2009.10719777.
- ↑ Faller P (14 de diciembre de 2009). «Copper and zinc binding to amyloid-beta: coordination, dynamics, aggregation, reactivity and metal-ion transfer». ChemBioChem 10 (18): 2837-45. PMID 19877000. doi:10.1002/cbic.200900321.
- ↑ «Abeta-mediated ROS production by Cu ions: structural insights, mechanisms and relevance to Alzheimer's disease». Biochimie 91 (10): 1212-7. October 2009. PMID 19332103. doi:10.1016/j.biochi.2009.03.013.
- ↑ Marangon, Karine; Devaraj, Sridevi; Tirosh, Oren; Packer, Lester; Jialal, Ishwarlal (November 1999). «Comparison of the effect of α-lipoic acid and α-tocopherol supplementation on measures of oxidative stress». Free Radical Biology and Medicine 27 (9–10): 1114-1121. PMID 10569644. doi:10.1016/S0891-5849(99)00155-0.
- ↑ «Mercury toxicity and antioxidants: part I: role of glutathione and alpha-lipoic acid in the treatment of mercury toxicity. (Mercury Toxicity).». Thorne Research Inc. 2002. Archivado desde el original el 22 de diciembre de 2015. Consultado el 20 de diciembre de 2015.
- ↑ «Evaluation of acute copper toxicity to larval fathead minnows (Pimephales promelas) in soft surface waters». Environ. Toxicol. Chem. 24 (2): 408-14. February 2005. PMID 15720002. doi:10.1897/03-494.1.
- ↑ Ezeonyejiaku, CD, Obiakor, MO and Ezenwelu, CO (2011). «Toxicity of copper sulphate and behavioural locomotor response of tilapia (Oreochromis niloticus) and catfish (Clarias gariepinus) species.». Online J. Anim. Feed Res. 1 (4): 130-134.
- ↑ C. A. Flemming; J. T. Trevors (1989). «Copper toxicity and chemistry in the environment: a review». Water, Air, & Soil Pollution 44 (1–2): 143-158. Bibcode:1989WASP...44..143F. doi:10.1007/BF00228784.
- ↑ Earley, Patrick J.; Swope, Brandon L.; Barbeau, Katherine; Bundy, Randelle; McDonald, Janessa A.; Rivera-Duarte, Ignacio (1 de enero de 2014). «Life cycle contributions of copper from vessel painting and maintenance activities». Biofouling 30 (1): 51-68. ISSN 0892-7014. PMC 3919178. PMID 24199998. doi:10.1080/08927014.2013.841891.
- ↑ «Is Copper Bottom Paint Sinking? - BoatUS Magazine». Consultado el 22 de septiembre de 2016.
- ↑ «Marine Coatings: Making Sense of U.S., State, and Local Mandates of Copper-Based Antifouling Regulations - American Coatings Association» (en inglés estadounidense). Consultado el 22 de septiembre de 2016.
- ↑ Prociv P (September 2004). «Algal toxins or copper poisoning--revisiting the Palm Island "epidemic"». Med. J. Aust. 181 (6): 344. PMID 15377259. doi:10.5694/j.1326-5377.2004.tb06316.x.