Ácido fluoroantimónico
El ácido fluoroantimónico (HSbF6) es una mezcla de fluoruro de hidrógeno y pentafluoruro de antimonio en diversas proporciones.[2] La proporción 1:1 conduce al superácido más fuerte conocido, el cual se ha demostrado que protona incluso a los hidrocarburos para producir carbocationes e H2. El ácido fluoroantimónico es el más corrosivo de los llamados super ácidos.[3]
| Ácido fluoroantimónico | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Hexafluoroantimonato (VI) de hidrógeno | ||
| General | ||
| Fórmula semidesarrollada | HF-SbF5 | |
| Fórmula estructural |
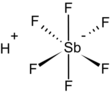 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | [16950-06-4][1] | |
| ChemSpider | 21241496 | |
| PubChem | 6337100 | |
| Propiedades físicas | ||
| Apariencia | jarabe incoloro | |
| Masa molar | 236,808 g/mol | |
| Propiedades químicas | ||
| Acidez | -31 pKa | |
| Solubilidad en agua | Se descompone, generando una explosión química | |
| Peligrosidad | ||
| Frases R | R39/23/24/25-35 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
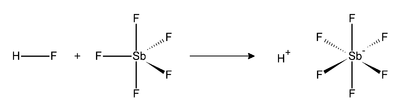
La reacción de fluoruro de hidrógeno (HF) y SbF5 es exotérmica. HF libera el catión (H+), y su base conjugada (F−) es secuestrada por una o más moléculas de SbF5 para producir SbF6− octaédrico. Este anión se clasifica como no coordinante, porque es tanto un nucleófilo débil y una base muy débil. El catión H+ permanece efectivamente «desnudo», lo que trae como consecuencia la extrema acidez del sistema. El ácido fluoroantimónico es 2×1019 veces más fuerte que el ácido sulfúrico. La reacción del fluoruro de hidrógeno y pentafluoruro de antimonio procede como sigue:
Estructura
editarSe han cristalizado dos productos relacionados con las mezclas HF-SbF5, y ambos han sido analizados por cristalografía de rayos-X de un solo cristal. Estas sales tienen las fórmulas [H2F+][Sb2F11−] y [H3F2+][Sb2F11−]. En ambas sales, el anión es Sb2F11−.[4] Como se mencionó anteriormente, SbF6− está clasificado como una base débil; el monoanión de mayor tamaño Sb2F11− sería más débil aún.
Comparación con otros ácidos
editarLos siguientes valores están basados en la función de acidez de Hammett. La acidez se indica con valores negativos de H0.
- Ácido fluoroantimónico (1990) (H0 Value = −31.3)
- Ácido mágico (1974) (H0 Value = −19.2)
- Superácido carborano (1969) (H0 Value = −18.0)
- Ácido fluorosulfúrico (1944) (H0 Value = −15.1)
- Ácido tríflico (1940) (H0 Value = −14.9)
Aplicaciones
editarEste ácido extraordinariamente fuerte protona casi todos los compuestos orgánicos. En 1967, Bickel y Hogeveen mostraron que la mezcla HF-SbF5 eliminará H2 del metilpropano y metano del neopentano:[5][6]
- (CH3)3CH + H+ → (CH3)3C+ + H2
- (CH3)4C + H+ → (CH3)3C+ + CH4
Seguridad
editarHF-SbF5 se descompone por acción del agua de forma rápida y explosiva. Reacciona con prácticamente todos los disolventes conocidos. Algunos disolventes que se ha probado que son compatibles con HF-SbF5 son el clorofluoruro de sulfurilo y el óxido de azufre (IV). También se han usado clorofluorocarbonos como disolventes. Los contenedores para HF-SbF5 están hechos de PTFE. (recubrimiento de cohetes, aviones, etc.)
Referencias
editar- ↑ [16950-06-4 Número CAS]
- ↑ Olah, G. A.; Prakash, G. K. S.; Wang, Q.; Li, X. “Hydrogen Fluoride–Antimony(V) Fluoride” in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI: 10.1002/047084289.
- ↑ «¿Fluidos: Cuál es el ácido más corrosivo del del mundo?». GRM. Consultado el 4 de abril de 2024.
- ↑ Mootz, D.; Bartmann, K. (1988). «The Fluoronium Ions H2F+ and H3F2+: Characterization by Crystal Structure Analysis». Angewandte Chemie, International Edition in English 27: 391-392. doi:10.1002/anie.198803911.
- ↑ Bickel, A. F.; Gaasbeek, C. J.; Hogeveen, H.; Oelderik, J. M.; Platteeuw, J. C. (1967). «Chemistry and spectroscopy in strongly acidic solutions: reversible reaction between aliphatic carbonium ions and hydrogen». Chemical Communications 1967: 634-5. doi:10.1039/C19670000634.
- ↑ Hogeveen, H.; Bickel, A. F. (1967). «Chemistry and spectroscopy in strongly acidic solutions: electrophilic substitution at alkane-carbon by protons». Chemical Communications 1967: 635-6. doi:10.1039/C19670000635.