Fermentación kójica
| Fermentación kójica | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| 5-Hidroxi-2-(hidroximetil)-4H-piran-4-one | ||
| General | ||
| Otros nombres | ácido kójico, 5-Hidroxi-2-(hidroximetil)-4-pirona, 2-Hidroximetil-5-hidroxi-γ-pirona | |
| Fórmula semidesarrollada | C6H6O4 | |
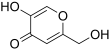
| Fórmula estructural |
 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 501-30-4[1] | |
| Número RTECS | UQ0875000 | |
| ChEBI | 43572 | |
| ChEMBL | CHEMBL287556 | |
| ChemSpider | 3708 | |
| DrugBank | DB01759 | |
| PubChem | 3840 | |
| UNII | 6K23F1TT52 | |
| KEGG | C14516 | |
|
C1=C(OC=C(C1=O)O)CO
| ||
| Propiedades físicas | ||
| Apariencia | polvo Tan | |
| Masa molar | 142.11 g/mol g/mol | |
| Punto de fusión | 152 K (−121 °C) - 155 K (−118 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | soluble | |
| Peligrosidad | ||
| Frases R | R36/37/38 | |
| Frases S | S22, S24/25 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Propiedades y antecedentes
editarEl ácido kójico se puede producir fácilmente por métodos microbiológicos. En el momento actual se fabrica comercialmente en escala limitada por fermentación fúngica.
El ácido kójico (5-hidroxi-2-hidroximetil-γ-pirona) está representado por la siguiente fórmula estructural:
Propiedades
editarEl ácido kójico es fácilmente soluble en acetona y acetato de etilo; soluble en proporción de 2.8g por 100ml en agua a 20 °C, y 6.8g por 100ml a 60 °C; algo menos soluble en etanol que en agua y poco soluble en cloroformo, éter y piridina.
Historia
editarSaito (1907) fue el primero en aislar el ácido como producto residual de la fermentación de arroz cocido por Aspergillus oryzae. Al añadir cloruro férrico a una solución acuosa del ácido se produce un intenso color rojo. Un bioquímico japonés, Yabuta, investigó este ácido, lo denominó ácido kójico (1912)y en 1924 estableció su constitución.
Traetta-Mosca (1914) demostró que el ácido kójico era producido por A. glaucus a partir de sacarosa, glucosa, fructuosa y glicerina. Nadine Wijkman (1924) lo obtuvo por fermentación de sacarosa empleando una variedad (innominada) de Aspergillus niger. Tres años más tarde, Kinoshita (1927) indicó que por empleo de cobaltoaminas como fuentes de nitrógeno para A. oryzae se aumentaba el rendimiento de ácido kójico a partir de sacarosa. Al añadir cloruro purpúreo-cobáltico en una concentración del 0.5% a un mosto con 10% de sacarosa se obtiene un rendimiento de 33% (en peso) de ácido kójico en 25 días.
En 1927, Tamiya indicó que diferentes aspergilios pueden producir ácido kójico a partir de sacarosa. Entre los mohos mencionados se hallaban A. oryzae; A. flaws, var.; A. gymnosardae; A. awamori; A. fumigatus, y A. giganteus.
En 1929, Challenger, Klein y Walter publicaron los resultados de sus investigaciones, que demostraron que A. oryzae puede producir ácido kójico partir de xilosa. En este mismo año, Katagiri y Kitahara notificaron la formación de este ácido a partir de pentosa, ácido glucónico y otras sustancias.
Microorganismos productores del ácido kójico
editarVarios mohos del género Aspergillus producen ácido kójico a partir de soluciones nutricias adecuadas. Además de los enumerados anteriormente, producen ácido kójico los siguientes: A. albus, A. effusus, A. nidulans, A. parasiticus, A. tamarii y Penicillum daleae. Entre las bacterias podemos citar varias especies de Acetobacter.
Sustancias nutricias
editarSuministradores de carbono. Un gran número de sustancias que contiene carbono han sido fermentadas por diferentes microorganismos con producción de ácido kójico. Entre ellas citaremos: almidones; dextrinas; disacáridos, como sacarosa y maltosa; las hexonas glucosa, fructuosa, manosa y galactosa; las pentosas xilosa y abarinosa; y sorbitol, dulcitol, i-adonitol, inulina, inositol, glicerina, β-glicerofosfato, dihidroxiacetona, ácido glucónico, ácido tartárico y otras sustancias. Los mayores rendimientos se han obtenido a partir de glucosa y xilosa.
Concentración de la sustancia glucídica. La concentración de las sustancias empleadas varía del 5 al 30%. May y colaboradores (1931) emplearon en sus trabajos concentraciones de azúcar que variaban del 15 al 33%. Obtuvieron los mayores rendimientos con A. flaws empleando una concentración de glucosa del 20%. Barham y Smits (1936hallaron que una concentración de xilosa del 15% era la más probable para la fermentación. Katagiri y Kitahara emplearon concentraciones del 5% de un gran número de sustancias con resultados satisfactorios. La misma concentración ha sido adoptada por otros investigadores.
Sales nutritivas
editarA continuación se indican los tipos de sales nutritivas empleadas para la producción del ácido kójico.
| Sales | g/L de solución de glucosa! |
|---|---|
| MgSO4*7H2O | |
| KCl | |
| H3PO4 | |
| NH4NO3 |
El medio de Kinoshita (1927), conocido también por medio K, tiene la composición siguiente:
| Sales | g/L de solución de glucosa! |
|---|---|
| KH2PO4 | |
| KCl | |
| NH4NO3 |
Katagiri y Kitahara emplearon medios que contenían 0.01% de MgSO4 * 7H2O, 0.1% de KH2PO4, 0.05% (NH4)2SO4 Y 0.01% de CaCl junto al 5% de sustancia glúcida.
Puede producirse ácido kójico en el medio de Czapek-Dox.
El nitrato amónico es muy satisfactorio como fuente de nitrógeno. Aparentemente se obtienen mejores resultados cuando la concentración salina es pequeña, pero lo suficientemente grande para permitir el desarrollo del moho.
Otras características de la fermentación
editarpH
editarEl pH óptimo para la producción del ácido kójico debe determinarse por experimentación en cada caso si no se conoce con anterioridad. Varios investigadores han empleado el intervalo de 2 a 5 más.
Katagiri y Kitahara emplearon un pH inicial de 5 para favorecer el desarrollo de A. oryzae; pero hallaron que el de 2.4 estimulaba la formación de ácido kójico. Tamiya halló que el pH óptimo para la fermentación de la sacarosa era de 5.5. Barham y Smits obtuvieron los mayores rendimientos en la fermentación de xilosa por A. flaws empleando un intervalo de pH de 2 a 3.5. En su opinión el Ph óptimo para la fermentación es el más bajo que pueda tolerar el microorganismo.
La adición de carbonato cálcico a una fermentación kójica produce una disminución en el rendimiento de ácido, que se atribuye a un cambio en al Ph del mosto.
Efecto de las adiciones
editarEn un estudio de 40 compuestos orgánicos, May y colaboradores encontraron que la etilenclorhidrina en concentración de 100 mg/L producía un marcado de aumento en la producción de ácido kójico en el intervalo de 10 días.
Los ácidos oxálico, fórmico, clorhídrico, y nítrico inhiben la formación del ácido.
Temperatura
editarEl intervalo óptimo para la fermentación es de 29 a 35 °C. Según May y colaboradores la temperatura óptima para Aspergillus flaws, es de 33 a 35 °C. Katagiri y Kitahara emplearon las de 29 a 31 °C; Barham y Smits, de unos 35 °C, y Gould, de 20 °C. A veces puede hacerse bajas la temperatura hasta 25 °C o más (después que la fermentación ha transcurrido durante 5 días a una temperatura más elevada), obteniéndose un aumento en los rendimientos.
Duración de la fermentación
editarLa fermentación requiere de 9 a 20 días para completarse, período que depende del tipo de sustrato, especie del moho, con lo que disminuye el rendimiento.
Rendimientos
editarEn la acción de A. flaws sobre soluciones de glucosa se obtiene rendimientos de 50 a 60%.
La siguiente tabla indica la naturaleza de los rendimientos obtenidos a partir de varios compuestos por Katagiri y Kitahara.
CANTIDAD DE ÁCIDO KÓJICO PRODUCIDA POR A. ORYZAE (En 100 ml de cultivo de 20 días que contenía 5 g de sustancia.)
| SUSTANCIA | g/100mL | Rendimiento referente al azúcar | Observado X SAKAGUCHI | Observado X TAMIYA |
|---|---|---|---|---|
| Glucógeno | ||||
| Insulina | ||||
| Sacarosa | ||||
| Maltosa | ||||
| Lactosa | ||||
| Trealosa | ||||
| Glucosa | ||||
| Fructuosa | ||||
| Manosa | ||||
| Galactosa | ||||
| cα–Metaglucósido | ||||
| Ramnosa | ||||
| Arabinosa | ||||
| Xilosa | ||||
| Dihidroxiacetona | ||||
| Gliceraldehído | ||||
| Metilglioxal | ||||
| Inosita | ||||
| Manita | ||||
| Sorbita | ||||
| Dulcita | ||||
| Eritrita | ||||
| Glicerina | ||||
| Glicerinofosfato Sódico | ||||
| Etile-Glicol | ||||
| Alcohol Etílico | ||||
| Alcohol Metílico | ||||
| Ácido Metílico | ||||
| Ácido Glucónico | ||||
| Ácido Sacárico | ||||
| Ácido Lactobiónico | ||||
| Ácido Arabónico | ||||
| Ácido Glicerico | ||||
| Ácido Acético | ||||
| Ácido Succínico | ||||
| Ácido Tartárico | ||||
| Ácido Oxálico | ||||
| Ácido Acético |
Reacciones
editarUna de las valiosas características del ácido kójico es su reactividad. Las reacciones suelen afectar a los grupos hidroxílicos, de los cuales el nuclear es el primero que reacciona. A partir de ácido kójico se pueden formar quelatos insolubles en agua, piridinas, piridonas, ésteres, éteres, productos de condensación, derivados de halogenados y otros productos.
Usos
editarEl ácido kójico tiene un gran número de usos potenciales. Se puede emplear como reactivo analítico, particularmente para el hierro; como insecticida; como antibiótico; como producto intermedio para la obtención de quelatos metálicos, y para otros muchos fines.
Mecanismo de la fermentación de ácido kójico
editarSe han dado varios esquemas para explicar la producción de ácido kójico por fermentación, de los cuales vamos a considerar algunos brevemente.
Según Yabuta, el ácido procede directamente de la glucosa por un proceso sencillo de oxidación y deshidratación:
Kinoshita (1927) y Haworth (1928) dieron una explicación similar a la producción del ácido kójico, basándose en el hecho de que la glucosa da lugar a grandes cantidades del ácido en relación con otros compuestos de carbono. En esta teoría no explica la formación del ácido a partir de los compuestos que tengan menos de 6 átomos de carbono (como las pentosas, glicerina y dihidroxiacetona) ni de los de 7 átomos de carbono.
Corbellini y Gregorini (1930) sugirieron que a partir de los compuestos tricarbonados pueden condensarse para formar una molécula que pasa a ácido kójico por deshidratación:
Químicamente, las pironas se forman sin dificultad por deshidratación de las policetonas acíclicas.
May y colaboradores participan de la opinión enunciada por Corbellini y Gregorini, según la cual el ácido kójico es sintetizado a partir de alguna sustancia que contenga 2 o 3 átomos de carbono. Según ellos (May y colaboradores), la 1-hidroxiacetil-3-formil-3-hidroxiacetona puede ser el compuesto precursor del ácido kójico, aunque no haya sido aislada de los productos de fermentación:
Birkinshaw, Charles, Lilly, y Raistick (1931) han propuesto dos teorías para explicar el mecanismo de la fermentación. Una de ellas sugiere la formación del ácido mediante la condensación de acetaldehído. Esta teoría se basa en el hecho de que frecuentemente se halla alcohol en las fermentaciones por mohos, especialmente en aquellas en que el ácido kójico es uno de los finales. También se ha sugerido que la presencia de acetaldehído como precursor. Katagiri y Kitahara (1929) demostraron la presencia del acetaldehído (por fijación de sulfito) en la fermentación de distintos medios por Aspergillus oryzae (azul de Higuchi). Sakaguchi halló que el etanol aumenta el rendimiento en ácido kójico a partir de soluciones de glucosa. Por tanto, se creía que el etanol podía ser un producto de intermedio en la fermentación.
Según Gould (1938), la adición de agentes de fijación (como el sulfito y dimedón) a mostos en fermentación por A. tamarii no impidió la formación del ácido kójico, ni se pudieron asilar los productos de fijación.
Katagiri y Kitahara (1933) afirman que no se halló ácido kójico a partir de medios que contenían hexadifosfato cálcico o hexamonofosfato de calcio y magnesio. Tampoco pudieron obtener ácido kójico a partir de medios que contenían acetaldehído, acetona o ácido pirúvico, parapirúvico y acetilacético.
Por tanto, el que algunas fermentaciones por moho produzcan etanol y acetaldehído no es suficiente prueba de su presencia como producto0s intermedios en la formación de ácido kójico.
Según la segunda teoría expuesta por Birkinshaw y colaboradores, a partir de la sustancia carbonada se sintetiza un hidrato de carbono de reserva que posteriormente se hidroliza a un compuesto que puede convertirse en ácido kójico.
Las investigaciones llevadas a cabo por Gould indican que no es probable que el ácido kójico se produzca a partir de los hidratos de carbono de reserva. Gould desarrollo capas miceliares de A. tamarii en medios que contenían distintas sustancias carbonadas. Se lavaron estas capas y una vez limpias de ácido kójico se secaron y molieron hasta polvo muy fino. Este polvo se empleó en el medio de Czapek-Dox para sustituir el azúcar. En 90 días no se produjo ácido kójico.
Tamiya indicó entre los constituyentes del medio podía sintetizarse una hexosa que daría el origen al ácido kójico.
En 1931, Challenger, Klein y Walter dieron a conocer que A. oryzae producía un rendimiento mayor del 30% del teórico a partir de dihidroxiacetona. Propusieron el esquema siguiente:
Challenger y colaboradores suponían así que la dihidroxiacetona o el aldehído glicérico eran los productos intermedios lógicos en la formación de ácido kójico.
Katagiri y Kitahara (1933), como resultado de una extensa investigación, concluyen que, de todas las sustancias sugeridas, la dihidroxiacetona es la que probablemente desempeña el papel más importante en la formación del ácido kójico.
Arnstein y Bentley (1950;1953 a, b, c; 1956), han realizado múltiples investigaciones sobre el mecanismo de la formación de ácido Kójico por A. oryzae y A. flaws-oryzae, usando compuestos con átomos de carbono marcados. Como resultado de sus estudios, durante los cuales demostraron (1953 b) la presencia de Aldolasa y de Triosafosfato-Isomerasa en los mohos, llegaron a la conclusión (1953 c) de que en la biosíntesis del ácido Kójico intervienen tres procesos metabólicos diferente:
- Formación directa a partir de glucosa sin rotura de la cadena carbonada.
- Formación a partir de triosafosfatos.
- Incorporación de pequeñas moléculas tales como acetato, piruvato y glicopola, en los átomos de carbono 4, 5 y 6 del ácido Kójico.
Como resultado de sus trabajos con glucosa y dihidroxiacetona marcadas con 14C (1953 a), consideran que el ácido Kójico se origina sobre todo por conversión directa de la glucosa. Opinan (1956), basados en sus estudios con D-(1-14C)-Ribosa como sustrato para A. flaws, que a partir de la pentosa se forman un precursor en Cβ y ácido Kójico por la vía de las reacciones transcetolásica y transaldolásica. Postulan que el tercer esquema de los mencionados es una extensión del anterior y que las pequeñas moléculas forman todas ellas un precursor común en C3. Que se incorpora esencialmente a los átomos de carbono 4,5 y 6 del ácido Kójico.
La siguiente figura presenta dos esquemas de Armstein y Bentley para la formación del ácido Kójico a partir de pentosas a través de las reacciones transcetolásicas y transaldolásticas: