Ácido tiocarboxílico
| Ácidos tiocarboxílicos |
|---|
 Forma tiona (Ácido O-carbotioico) |
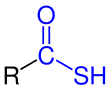 Forma tiol (Ácido S-carbotioico) |
 Ácido ditiocarboxílico |
| R es un grupo organilo. Los grupos funcionales están marcados en azul. |
Los ácidos tiocarboxílicos son compuestos organosulfurados relacionados con los ácidos carboxílicos mediante el reemplazo de uno de los átomos de oxígeno con un átomo de azufre. Son posibles dos tautómeros: una forma de tiona (RC(S)OH) y una forma de tiol (RC(O)SH).[1] A veces también se les denomina "ácido O-carbotioico" y "ácido S-carbotioico" respectivamente. De estos, la forma de tiol es la más común (por ejemplo, el ácido tioacético).
Un ácido tiocarboxílico natural es el ácido 2,6-piridinadicarbotioico, un sideróforo.
Síntesis
editarLos ácidos tiocarboxílicos se preparan típicamente por metátesis salina a partir del cloruro de acilo, como en la siguiente conversión de cloruro de benzoilo en ácido tiobenzoico usando hidrosulfuro de potasio de acuerdo con la siguiente ecuación idealizada:[2]
Reactividad
editarLos ácidos tiocarboxílicos son aproximadamente 100 veces más ácidos que los ácidos carboxílicos análogos. Así, a pH neutro, los ácidos están completamente ionizados. Las sales de sus bases conjugadas (por ejemplo, el tioacetato de potasio) sirven como reactivos para instalar grupos tiol a través del desplazamiento de haluros de alquilo para dar el tioéster, que a su vez es susceptible a la hidrólisis. Para el ácido tiobenzoico (PhC(O)SH) el pKa = 2,48. Para el ácido tioacético, el pKa está cerca de 3.4.[3]
Los ácidos tiocarboxílicos reaccionan con varios grupos funcionales de nitrógeno, como los compuestos orgánicos de azidas, nitroderivados e isocianato, para dar amidas en condiciones suaves.[4][5] Este método evita la necesidad de una anilina u otra amina altamente nucleófila para iniciar una sustitución de acilo formadora de amida, pero requiere la síntesis y el manejo del ácido tiocarboxílico inestable.[5] A diferencia de la reacción de Schmidt u otras vías de ataque nucleofílico, la reacción con una aril- o alquil azida comienza con una cicloadición [3 + 2]; el heterociclo resultante expulsa N2 y el átomo de azufre para dar la amida monosustituida.[4]
Ácidos ditiocarboxílicos
editarLos ácidos ditiocarboxílicos, con la fórmula RCS2H, son menos comunes que los monotioderivados. Son aproximadamente 3 veces más ácidos que los ácidos monotiocarboxílicos. Por lo tanto, para el ácido ditiobenzoico, el pKa = 1,92.[3] Dichos compuestos se preparan comúnmente mediante la reacción de sulfuro de carbono con un reactivo de Grignard:[6]
Esta reacción es comparable a la formación de ácidos carboxílicos utilizando un reactivo de Grignard y dióxido de carbono. Las sales de ditiocarboxilato son fácilmente S-alquiladas para dar ésteres de ditiocarboxilato:[7]
Los ácidos arilditiocarboxílicos, como por ejemplo, el ácido ditiobenzoico, se puede clorar para dar los cloruros de tioacilo.
Véase también
editarReferencias
editar- ↑ Cremlyn, R.J. (1996). An introduction to organosulfur chemistry. Chichester: Wiley. ISBN 0-471-95512-4.
- ↑ (1963) "Thiobenzoic Acid". Org. Synth.; Coll. Vol. 4: 924.
- ↑ a b M. R. Crampton (1974). «Acidity and hydrogen-bonding». En Saul Patai, ed. The Chemistry of the Thiol Group. Chichester: John Wiley & Sons Ltd. p. 402.
- ↑ a b «21.1.2.6.1: Variation 1: From thiocarboxylic acids». Science of Synthesis: Houben–Weyl Methods of Molecular Transformations. Vol. 21: Three Carbon-Heteroatom Bonds: Amides and Derivatives; Peptides; Lactams. Georg Thieme Verlag. 2005. pp. 52-54. ISBN 9783131719515.
- ↑ a b Xie, Sheng; Zhang, Yang; Ramström, Olof; Yan, Mingdi (2016). «Base-catalyzed synthesis of aryl amides from aryl azides and aldehydes». Chem. Sci. 7: 713-718. PMC 5952891. doi:10.1039/C5SC03510D.
- ↑ Ramadas, S. R.; Srinivasan, P. S.; Ramachandran, J.; Sastry, V. V. S. K. (1983). «Methods of Synthesis of Dithiocarboxylic Acids and Esters». Synthesis 1983 (8): 605-622. doi:10.1055/s-1983-30446.
- ↑ Frederick Kurzer, Alexander Lawson (1962). «Thiobenzoylthioglycolic Acid». Org. Synth. 42: 100. doi:10.15227/orgsyn.042.0100.