Anemia de células falciformes
La anemia de células falciformes,[nota 1] llamada también drepanocitosis o anemia drepanocítica, es una alteración de la sangre que hace que los glóbulos rojos se deformen hasta adquirir apariencia de hoz (de ahí el nombre de «eritrocitos falciformes» o «drepanocitos»). Esta deformidad estructural entorpece la circulación sanguínea y causa en el enfermo obstrucciones vasculares, microinfartos en múltiples órganos y hemólisis. Se trata de una anemia crónica y grave que se diagnostica mediante el estudio de la hemoglobina, la molécula que transporta el oxígeno en la sangre.[2]
| Anemia de células falciformes | ||
|---|---|---|
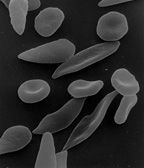 Glóbulos rojos falciformes o en forma de hoz. | ||
| Especialidad | hematología | |
| Complicaciones | Dolor crónico, accidente cerebrovascular, necrosis ósea aséptica, cálculos biliares, úlceras en las piernas, priapismo, hipertensión pulmonar, problemas de visión, problemas renales | |
| Sinónimos | ||
|
Anemia drepanocítica. Anemia causada por drepanocitos. Enfermedad de la hemoglobina SS (Hb SS). Enfermedad de células falciformes o sickle-cell. | ||
La enfermedad tiene su origen en la sustitución, consecuencia de una mutación genética, de un aminoácido polar (el ácido glutámico) por otro no polar (la valina) en la sexta posición de la cadena de globina β, uno de los componentes de la hemoglobina adulta (HbA1)[3] de tal manera que disminuye la unión de oxígeno y el eritrocito se atrofia.
Terminología
editarEn la literatura científica se designa esta alteración con múltiples denominaciones, además de las mencionadas: «drepanocitemia», «enfermedad de células falciformes» o «hemoglobinopatía S homocigota»; otros nombres, ya en desuso, son: «anemia de la hemoglobina S», «anemia de Herrick», «anemia microdrepanocítica», «enfermedad de la hemoglobina S» o «meniscocitosis». La expresión «anemia falciforme» es inexacta, ya que lo que tiene forma de hoz son los eritrocitos, no la anemia en sí.[2][4] El término siclemia, híbrido impropio formado a partir del inglés sickle cell anemia es incorrecto.
Fisiopatología
editarA diferencia de los hematíes normales, que generalmente son bicóncavos, con una forma similar a la de una rosquilla, los glóbulos rojos falciformes tienen forma de media luna o de hoz.[5] Este cambio en la morfología del glóbulo rojo se debe a una mutación puntual sustitutiva de un residuo de ácido glutámico por un residuo de valina en la sexta posición de la cadena de globina β, que forma parte de la molécula de hemoglobina. Su presencia determina alteraciones en la estructura de la célula. La membrana plasmática se vuelve rígida y viscosa. La célula se deshidrata por salida de potasio y entrada de calcio. Al exponerse a bajas presiones parciales de oxígeno, se forman fibras poliméricas de hemoglobina S; que produce las alteraciones en la morfología del eritrocito, a la vez que una menor capacidad para transportar oxígeno.
Estas células modificadas presentan menor deformabilidad, asociada a su vez con una mayor expresión de moléculas de adhesión en la superficie de la membrana plasmática. Estas características provocan atascamiento de dichos eritrocitos en la microcirculación, llevando a un obstrucción del flujo sanguíneo (isquemia) con la consiguiente disminución del aporte de oxígeno al tejido (hipoxia). Estas microisquemias pueden provocar crisis dolorosas, con posible lesión tisular y liberación de mediadores proinflamatorios y nociceptivos.[6]
Causa
editarLa anemia de células falciformes es una enfermedad genética autosómica recesiva[7] resultado de la sustitución de timina por adenina en el gen de la globina beta, ubicado en el cromosoma 11,[8] lo que conduce a una mutación de ácido glutámico por valina en la posición 6 de la cadena polipeptídica de globina beta y a la producción de una hemoglobina funcionalmente defectuosa, la hemoglobina S. El ácido glutámico tiene carga negativa y la valina es hidrófoba, entonces se forman contactos con alanina, fenilalanina y leucina, lo que promueve polímeros cruzados que deforman el glóbulo rojo.
La transformación del eritrocito se produce cuando no transporta oxígeno, pues con oxihemoglobina el glóbulo tiene la forma clásica bicóncava.
Genética
editarLa transmisión génica se debe a un gen de herencia autosómica recesiva del cromosoma 11; así pues los individuos homocigóticos recesivos (SS) sólo producen globina beta con valina. El número de hematíes falciformes alcanza todo el tracto venoso y cualquier esfuerzo podría provocarles la muerte. Afecta a 4 por cada mil individuos de la población afroamericana.
En Estados Unidos, la mayoría de las personas que tienen la enfermedad de células falciformes son de ascendencia africana o se identifican como de raza negra. Aproximadamente 1 de cada 13 bebés negros o afroamericanos nace con el rasgo de células falciformes.[9]
Los individuos heterocigóticos (AS) fabrican la mitad de globina beta con ácido glutámico y la otra mitad con valina, de tal manera que sólo una centésima parte de sus eritrocitos son células falciformes. Pueden llevar una vida bastante normal, aunque no les es muy recomendable hacer grandes esfuerzos. Padecen una leve anemia a veces incluso inapreciable. Afecta al 8 % de la población afroamericana.
Los estudios muestran que en las zonas donde el paludismo o malaria era o es un problema, los individuos que heredan un solo alelo de la hemoglobina S —y que por tanto son portadores del rasgo de la célula falciforme— son resistentes a las infecciones de malaria y tienen una ventaja para sobrevivir sobre los individuos con genes de globina normales.[10] A medida que las poblaciones iban migrando de un lugar a otro, la transformación de la célula falciforme se extendió a otras zonas del Mediterráneo y de allí al Oriente Medio, y finalmente al hemisferio occidental (a causa, entre otras cosas, del mercado de esclavos negros).
En los Estados Unidos y otros países en los que el paludismo no es un problema, el gen de la hemoglobina falciforme no constituye ya una ventaja para sobrevivir. En cambio, puede ser una seria amenaza para los hijos del portador, ya que estos pueden heredar dos genes anormales de hemoglobina falciforme y entonces desarrollar anemia falciforme.
Tratamiento
editarEntre las opciones terapéuticas se cuenta con:
- Hidroxiurea
- L-glutamina
- Transfusión de glóbulos rojos
- Voxelotor (2019)[11]
- Crizanlizumab (2019)[12]
Penicilina
editarLos niños con anemia drepanocítica son más susceptibles a sufrir infecciones por bacterias como Streptococcus pneumoniae (también conocido como neumococo), que puede causar meningitis, neumonía y sepsis. La administración de penicilina V —por vía oral— reduce mucho el riesgo de enfermedad.[13] Se debe dar desde el nacimiento hasta los cinco años o incluso prolongarse durante toda la vida si se ha sufrido una infección neumocócica grave, una esplenectomía, un trasplante de precursores hematopoyéticos o se tiene asplenia funcional.[14][15]
Trasplante de progenitores hematopoyéticos
editarEn un artículo publicado en la revista "Essence" en septiembre de 2011 se menciona un tratamiento alternativo para pacientes de anemia falciforme a base de células madre. Es el caso de una familia en donde uno de sus hijos tenía esta condición. Los profesionales de salud optaron por el trasplante de células madre del cordón umbilical de un hermano que no era portador de la enfermedad. Los médicos extrajeron células madre del cordón y al paciente se le expuso a quimioterapia, para evitar la reproducción de glóbulos rojos deformes. Tras tres meses de haber introducido de forma intravenosa las células madre, al paciente se le declaró sano. Otro ejemplo en España fue la de una niña nacida en 2011 y diagnosticada en 2015, Diama, frente a lo cual su madre tuvo una hermana compatible y sana seleccionada genéticamente en 2019, Sokna: aun así la sangre del cordón umbilical no fue suficiente y sólo se pudo completar el tratamiento mediante médula ósea, con efectos positivos en menos de dos años[16]
El mayor problema es el costo de conservar esas células madre para hacer el trasplante. Con respecto al índice de éxito de la operación, este se acerca al 90 % para niños y decrece en función de la edad, hasta el punto que para adultos no hay muchas probabilidades de que la operación sea exitosa.[17]
Véase también
editarNotas
editarReferencias
editar- ↑ «falciforme». Diccionario de la Lengua Española.
- ↑ a b Real Academia Nacional de Medicina, ed. (2011). Diccionario de términos médicos. Madrid: Médica Panamericana. p. 93. ISBN 978-84-9835-183-5.
- ↑ Devlin, Thomas M. (2004). Bioquímica: Libro de texto con aplicaciones clínicas (4ta edición). Reverté. pp. 112, 238. ISBN 84-291-7208-4. Consultado el 25 de septiembre de 2012.
- ↑
- ↑ Ayala, Francisco J.; Kiger, John A. (1984). Genética moderna. Barcelona: Omega S.A. p. 349-50. ISBN 84-282-0720-8.
- ↑ Benz, 2016, p. 636.
- ↑ Patología estructural y funcional de Robbins pag 142
- ↑ HBB hemoglobin subunit beta, Homo sapiens. NCBI Gene database, Gene ID: 3043
- ↑ «Enfermedad de células falciformes - Causas y factores de riesgo | NHLBI, NIH». www.nhlbi.nih.gov (en inglés). 26 de agosto de 2022. Consultado el 22 de mayo de 2023.
- ↑ Ayala, Francisco J.; Kiger, John A. (1984). Genética moderna. Barcelona: Omega S.A. pp. 349-50. ISBN 84-282-0720-8.
- ↑ «OXBRYTA- voxelotor tablet, film coated». DailyMed.
- ↑ «ADAKVEO- crizanlizumab injection». DailyMed.
- ↑ Gaston, Marilyn H.; Verter, Joel I.; Woods, Gerald; Pegelow, Charles; Kelleher, John; Presbury, Gerald; Zarkowsky, Harold; Vichinsky, Elliott; Iyer, Rathi; Lobel, Jeffrey S.; Diamond, Steven; Holbrook, C. Tate; Gill, Frances M.; Ritchey, Kim; Falletta, John M. (19 de junio de 1986). «Prophylaxis with Oral Penicillin in Children with Sickle Cell Anemia». New England Journal of Medicine (en inglés) 314 (25): 1593-1599. PMID 3086721. doi:10.1056/NEJM198606193142501. Consultado el 11 de marzo de 2020.
- ↑ SEHOP, 2019, p. 47.
- ↑ Cober, MP; Phelps, SJ (julio de 2010). «Penicillin prophylaxis in children with sickle cell disease.». The journal of pediatric pharmacology and therapeutics. JPPT: the official journal of PPAG (en inglés) 15 (3): 152-9. PMC 3018247. PMID 22477807. Consultado el 11 de marzo de 2020.
- ↑ [1]
- ↑ Souter, E. (2011, September). The Sickle Cell Cure. Esence, 5, 210-212
Bibliografía
editar- SEHOP (2019). Cela, Elena; Ruiz, Anna; Cervera, Áurea, eds. Enfermedad de células falciformes. Guía de práctica clínica. ISBN 978-84-944935-5-3. Consultado el 11 de marzo de 2020.
- Benz, Edward J. (2016). «Hemoglobinopatías». Harrison. Principios de medicina interna (19.ª edición). McGraw-Hill Education. ISBN 9786071513373.
Enlaces externos
editar- MedPlus Diversos artículos sobre anemia drepanocítica.
- Manual Merck Capítulo 154: Anemias
- NIH: publicado bajo dominio público.
- En inglés
- EMedicine: emerg/26
- MeSH (Medical Subject Headings): C15.378.071.141.150.150
- ClinicalTrials.gov: Ensayos clínicos en materia de AF
- Entrez: Enlaces para AF