Dabigatrán
El dabigatrán es un anticoagulante de la clase de los inhibidores directos de la trombina. Se usa para tratar y prevenir coágulos de sangre y para prevenir accidentes cerebrovasculares en personas con fibrilación auricular . Específicamente, se usa para prevenir los coágulos de sangre después de un reemplazo de cadera o rodilla y en personas con antecedentes de coágulos previos. Se utiliza como alternativa a la warfarina y no requiere control mediante análisis de sangre.[1] Se toma por vía oral en forma del profármaco dabigatrán etexilato (comercializado como Pradaxa® desde abril de 2008 en los países europeos y como Pradax® en Canadá). Ha sido desarrollado por la empresa farmacéutica Boehringer Ingelheim. Su efecto puede ser antagonizado a través de la administración de idarucizumab.
| Dabigatrán | ||
|---|---|---|
 | ||
| Nombre (IUPAC) sistemático | ||
|
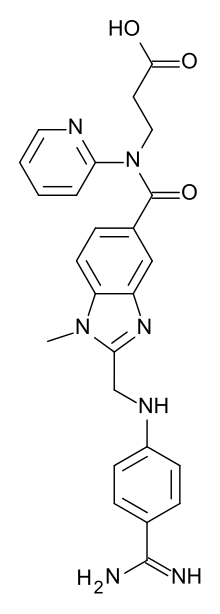
Etil 3-{[(2-{[(4-{N'-[(hexiloxi)carbonil] carbamimidoil}fenil)amino]metil}-1- metil-1H-benzimidazol-5-il)carbonil] (2-piridinil)amino}propanoato | ||
| Identificadores | ||
| Número CAS | 211915-06-9 211914-51-1 (sin etexilato) | |
| Código ATC | B01AE07 | |
| PubChem | 6445226 | |
| Datos químicos | ||
| Fórmula | C34H41N7O5 | |
| Peso mol. |
627,734 g/mol (471,511 sin etexilato) | |
| Datos clínicos | ||
| Estado legal | Anexo VI (CA), POM (UK) | |
| Vías de adm. | Oral | |
Desarrollo editar
El dabigatrán (inicialmente identificado como compuesto BIBR 953) fue descubierto a partir de un grupo de sustancias químicas con una estructura similar al inhibidor de la trombina basado en benzamidina α-NAPAP (N-alfa-(2-naftilsulfonilglicil)-4-amidinofenilalanina piperidida), que se conoce desde la década de 1980 como un potente inhibidor de diversas serinas-proteasas, en concreto la trombina pero también la tripsina. La adición de una cadena lateral hidrófoba dio lugar al profármaco de absorción oral BIBR 1048 (dabigatrán etexilato).[2]
A finales de la primera década del año 2000 se abordaron una serie de ensayos clínicos de fase III para el tratamiento y la prevención de la tromboembolia venosa (TEV) secundaria durante el posoperatorio en pacientes sometidos a cirugía ortopédica, y para la profilaxis a largo plazo en pacientes con síndrome coronario agudo e ictus con fibrilación auricular y TEV sintomática por diversas causas.[3] En las personas con fibrilación auricular, sería el primer competidor de la warfarina que se comercializara para la prevención del ictus,[4][5] aunque los evaluadores instaban a la precaución.[6]
Administración editar
Un estudio llevado a cabo en 2004 demostró un buen perfil de seguridad con dosis comprendidas entre 12,5 y 300 mg dos veces al día.[7]
En un estudio de fase II que comparó dabigatrán con enoxaparina sódica, se constató un aumento de la eficacia en la prevención de la trombosis en pacientes sometidos a cirugía ortopédica, pero un posible aumento del riesgo de hemorragia en pacientes que recibían dosis más altas de dabigatrán.[8] Un estudio de fase III que comparó dosis de dabigatrán de 150 mg y 200 mg administradas una vez al día con la dosis de referencia de 40 mg de enoxaparina una vez al día confirmó que el dabigatrán era tan eficaz como la enoxaparina en la prevención de la trombosis, con un perfil de riesgo similar.[9]
La absorción no se ve influida por los alimentos, pero puede disminuir si se toma con un inhibidor de la bomba de protones.[10] El metabolismo se ralentiza en sujetos que toman quinidina, verapamilo o amiodarona.
Autorización y uso editar
El 18 de marzo de 2008, la Agencia Europea de Medicamentos concedió la autorización de comercialización para el dabigatrán.[11] En el Reino Unido, el National Health Service ha autorizado su uso para prevenir la formación de trombos en pacientes sometidos a cirugía de cadera o rodilla. Las organizaciones sin ánimo de lucro, incluida la British Heart Foundation, abogan por la prescripción generalizada de este fármaco en sustitución de la warfarina, que tiene el inconveniente de tener que tomarla durante una semana para alcanzar un nivel objetivo de INR, y de la heparina, que se administra por vía intravenosa o subcutánea en su forma de bajo peso molecular. En 2008 se estimaba que el dabigatrán costaría al NHS británico 4,20 GBP al día, un coste equiparable al de otros anticoagulantes,[12] pero más de 10 veces el coste de la warfarina. El coste total del uso de la warfarina incluye no solo el precio de la medicación en sí, sino también el tiempo y el coste de controlar el INR, que no es necesario con dabigatrán.
En Canadá, la autorización llegó el 13 de junio de 2008.
Principales ensayos editar
RE-LY (Randomized Evaluation of Long-Term Anticoagulation Therapy) editar
Un estudio de fase III (ensayo de no inferioridad) , RE-LY, evaluó la eficacia y seguridad de dos dosis distintas de dabigatrán con respecto a warfarina en 18 113 pacientes con fibrilación auricular. Se asignó aleatoriamente a los pacientes con fibrilación auricular a uno de tres grupos de tratamiento: 1) warfarina en dosis ajustada; 2) dabigatrán de 110 mg dos veces al día; o 3) dabigatrán de 150 mg dos veces al día. El grupo de warfarina era abierto, pero los acontecimientos adversos fueron evaluados por revisores que desconocían el tratamiento recibido. El dabigatrán de 110 mg presentaba ausencia de inferioridad con respecto a warfarina para el criterio principal de valoración de la eficacia de ictus o embolia sistémica, mientras que el dabigatrán de 150 mg era significativamente más eficaz que la warfarina o el dabigatrán de 110 mg. Se produjo hemorragia grave con una frecuencia significativamente menor con dabigatrán de 110 mg que con warfarina; el dabigatrán de 150 mg produjo un número similar de episodios hemorrágicos que warfarina.[5]
El anticoagulante de Boehringer mostró una tendencia numérica en este estudio y en todos sus estudios clínicos a desarrollar infarto agudo de miocardio, hecho no menor a tener en cuenta en los pacientes con fibrilación auricular que pueden ser potencialmente cardiópatas. Asimismo, demuestra una elevada tasa de abandono en sus estudios clínicos debido a la epigastralgia (dolor de estómago) tras cada toma, determinada seguramente por el ácido tartárico presente en la cápsula (el dabigatrán necesita un medio ácido para su correcta absorción).
RE-COVER editar
Un gran ensayo (2539 pacientes) aleatorizado y doble ciego llevado a cabo recientemente por el grupo del estudio RE-COVER demostró la ausencia de inferioridad de dabigatrán cuando se comparó con warfarina en el tratamiento de la tromboembolia venosa aguda, con una tasa similar de hemorragias graves y una tasa combinada menor de hemorragias graves y no graves. Los pacientes asignados aleatoriamente a dabigatrán presentaron menos hemorragias leves, pero más episodios de dispepsia, y en ellos hubo más casos de suspensión del fármaco del estudio. A los pacientes tratados con dabigatrán no hubo que realizarles pruebas de coagulación.[13] Se amplió el estudio con el RE-COVER II[14]
Antídoto editar
El antídoto usado para una intoxicación por dabigatrán es Idarucizumab. Se trata de un fragmento de un anticuerpo monoclonal humanizado. Idarucizumab se une a dabigatrán y a sus metabolitos con una afinidad muy alta. De esta forma, va a neutralizar su efecto anticoagulante y -en principio -se podrá resolver la hemorragia.[15][16]
Referencias editar
- ↑ «Dabigatran Monograph for Professionals». Drugs.com (en inglés). Consultado el 22 de octubre de 2021.
- ↑ Hauel NH, Nar H, Priepke H, Ries U, Stassen JM, Wienen W (April 2002). "Structure-based design of novel potent nonpeptide thrombin inhibitors". J Med Chem 45 (9): 1757–66.|doi:10.1021/jm0109513. |PMID|11960487.|Lay summary Archivado el 3 de septiembre de 2009 en Wayback Machine.|
- ↑ Currently active clinical trials of Dabigatran at ClinicalTrials.gov http://www.clinicaltrials.gov/ct/search?term=Dabigatran&submit=Search
- ↑ Turpie AG (January 2008). "New oral anticoagulants in atrial fibrillation". Eur Heart J 29 (2): 155–65. doi:10.1093/eurheartj/ehm575. PMID 18096568.}}
- ↑ a b Connolly S, Ezekowitz MD, Yusuf S, et al. (2009). "Dabigatran versus warfarin in patients with atrial fibrillation". N Engl J Med 361 (12): 1139–51. doi:10.1056/NEJMoa0905561 Archivado el 26 de septiembre de 2011 en Wayback Machine.. PMID 19717844.
- ↑ Merli G, Spyropoulos AC, Caprini JA (August 2009). "Use of emerging oral anticoagulants in clinical practice: translating results from clinical trials to orthopedic and general surgical patient populations". Ann Surg 250 (2): 219–28. PMID 19638915.
- ↑ Eriksson BI, Dahl OE, Ahnfelt L, et al. (September 2004). "Dose escalating safety study of a new oral direct thrombin inhibitor, dabigatran etexilate, in patients undergoing total hip replacement: BISTRO I". J. Thromb. Haemost. 2 (9): 1573–80. doi:10.1111/j.1538-7836.2004.00890.x. PMID 15333033. http://www.blackwell-synergy.com/doi/full/10.1111/j.1538-7836.2004.00890.x (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última)..
- ↑ Eriksson BI, Dahl OE, Büller HR, et al. (January 2005). "A new oral direct thrombin inhibitor, dabigatran etexilate, compared with enoxaparin for prevention of thromboembolic events following total hip or knee replacement: the BISTRO II randomized trial". J. Thromb. Haemost. 3 (1): 103–11. doi:10.1111/j.1538-7836.2004.01100.x. PMID 15634273. http://www.blackwell-synergy.com/doi/full/10.1111/j.1538-7836.2004.01100.x (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última)..
- ↑ Eriksson BI, Dahl OE, Rosencher N, et al. (September 2007). "Dabigatran etexilate versus enoxaparin for prevention of venous thromboembolism after total hip replacement: a randomised, double-blind, non-inferiority trial". Lancet 370 (9591): 949–56. doi:10.1016/S0140-6736(07)61445-7. PMID 17869635.
- ↑ Stangier J, Eriksson BI, Dahl OE, et al. (May 2005). "Pharmacokinetic profile of the oral direct thrombin inhibitor dabigatran etexilate in healthy volunteers and patients undergoing total hip replacement". J Clin Pharmacol 45 (5): 555–63. doi:10.1177/0091270005274550. PMID 15831779.
- ↑ European Medicines Agency. "Public assessment report for Pradaxa" (PDF). http://www.emea.europa.eu/humandocs/PDFs/EPAR/pradaxa/H-829-en1.pdf (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).. Retrieved 2008-04-23.
- ↑ "Clot drug 'cold save thousands'". BBC News Online (BBC). 2008-04-20. http://news.bbc.co.uk/1/hi/health/7354818.stm. Retrieved 2008-04-21.
- ↑ Schulman S, Kearon C, Kakkar AK, et al (2009). "Dabigatran versus warfarin in the treatment of acute venous thromboembolism". N Engl J Med 361: pp. Online first. doi:10.1056/NEJMoa0906598. http://content.nejm.org/cgi/content/abstract/NEJMoa0906598v1 Archivado el 12 de abril de 2010 en Wayback Machine..
- ↑ Schulman, Sam; Kakkar, Ajay K.; Goldhaber, Samuel Z.; Schellong, Sebastian; Eriksson, Henry; Mismetti, Patrick; Christiansen, Anita Vedel; Friedman, Jeffrey et al. (18 de febrero de 2014). «Treatment of Acute Venous Thromboembolism With Dabigatran or Warfarin and Pooled Analysis». Circulation 129 (7): 764-772. doi:10.1161/CIRCULATIONAHA.113.004450. Consultado el 22 de octubre de 2021.
- ↑ Syed, Yahiya Y. (agosto de 2016). «Idarucizumab: A Review as a Reversal Agent for Dabigatran». American Journal of Cardiovascular Drugs (en) 16 (4): 297-304. PMID 27388764. doi:10.1007/s40256-016-0181-4.
- ↑ «Ficha técnica de la Agencia Europea del Medicamente».
Enlaces externos editar
- NEJM (necesita clave de acceso)[1]
- EMEA (ficha técnica del producto, acceso libre)