Feocromocitoma
Feocromocitoma es un tumor de la médula suprarrenal de la glándula adrenal. Se origina de las células cromafines y producen una secreción aumentada y no regulada de catecolaminas. Puede presentarse como un solo tumor o múltiples tumores. Las manifestaciones clínicas son producto de la secreción excesiva de catecolaminas, en particular hipertensión arterial.
| Feocromocitoma | ||
|---|---|---|
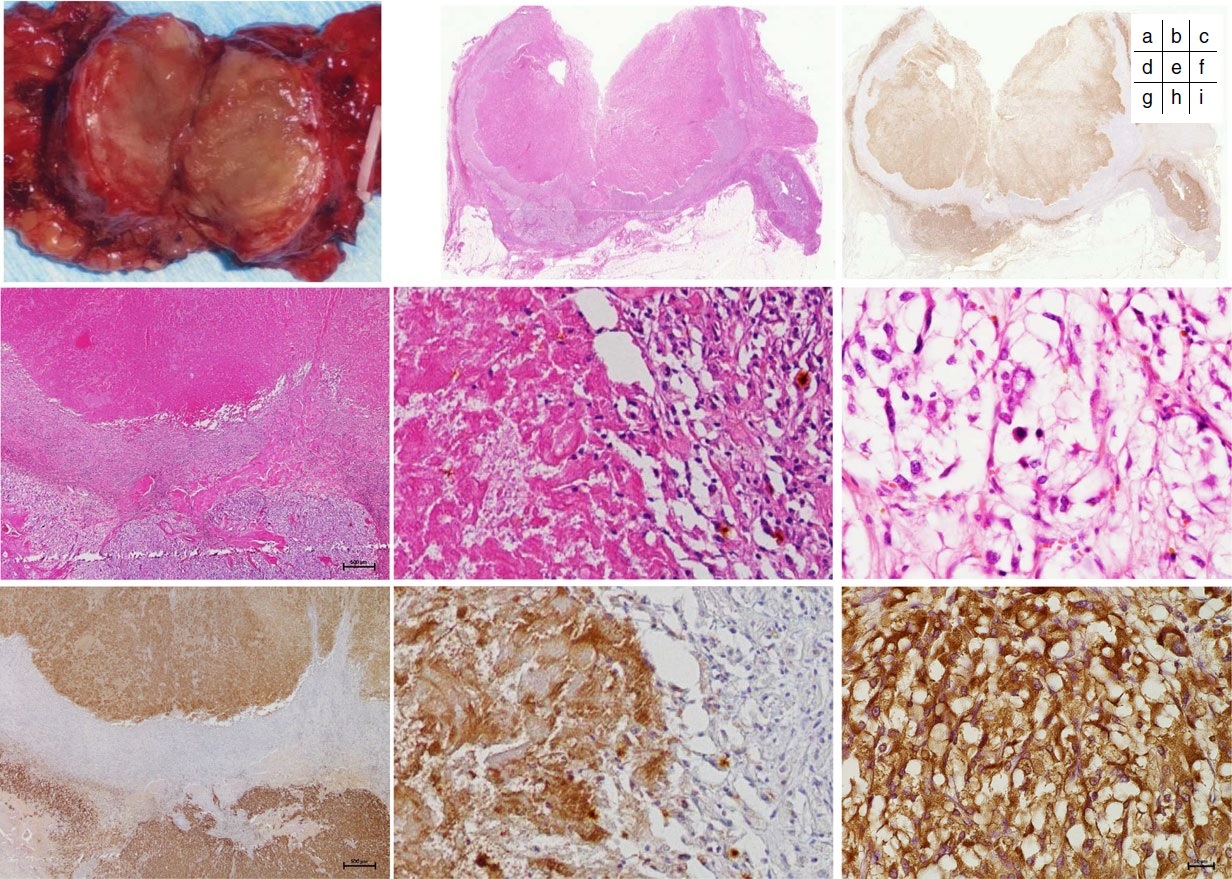 Histopatología de un feocromocitoma con necrosis coagulativa con inmunotinción | ||
| Especialidad |
oncología endocrinología | |
| Síntomas | Hipertensión , taquicardia , sudoración, dolor de cabeza , palidez | |
| Tratamiento | Cirugía, quimioterapia, radiación y agentes farmacológicos | |
Este raro tumor es letal si no es diagnosticado a tiempo.[1] También es conocido como paraganglioma adrenal.[2][3]
Historia editar
El primer caso probado fue diagnosticado por Felix Fraenkel describiendo los síntomas clásicos en una mujer joven de 18 años llamada Minna Roll[4] que murió en 1886 a causa de un tumor adrenal bilateral. Fraenkel concluyó correctamente que los signos y síntomas eran causados por un proceso en el cual alguna sustancia química era secretada por las células del tumor y pasaba a la sangre venosa o en el cual las células eran autodestruidas. Con estas conclusiones infirió que la medula adrenal era un órgano endocrino, aunque el producto secretado no se estableció hasta 10 años después cuando la adrenalina fue purificada por el químico japonés Takamine Jōkichi.[5]
El profesor y colega de Frankel, Max Schottelius realizó la investigación histológica, en conjunto con el profesor Rudolf Maier quien ejecutó la autopsia.[5] Max fue el primer patólogo en describir las características cromafines del tumor al fijarlo con la tinción de Muller que contiene cromato, lo que ocasionaba un cambio de color gris rojizo a café. Y al agregarle un fijador dicromato se tornaba café-negro debido a la oxidación de las catecolaminas de las células cromafines. Efecto por del cual fue denominado feocromocitoma por Ludwig Pick en 1912[2] (φαιοχρωμοκύττωμα, en Griego) que significa “masa de células color café- negro.[6]
Ciento veinte años después de este primer reporte, mediante una búsqueda en los familiares de la paciente, se logró determinar que se trataba de un feocromocitoma asociado a una neoplasia endocrina múltiple tipo 2 (MEN2).[4]
En 1926 fue realizada la primera resección exitosa de un feocromocitoma en la Mayo Clinic en Estados Unidos por el Dr. C, H Mayo y por Roux en Suiza[7] Sin embargo fue hasta el 2017 que la Organización mundial de la salud (OMS) clasificó el feocromocitoma como un tumor adrenal.[2]
Epidemiologia editar
La incidencia de feocromocitoma y paraganglioma es aproximadamente 0.6 casos por 100,00 personas al año.[2] Mujeres y hombres son afectados por igual. Pueden aparecer en cualquier edad pero son más comunes de la tercera y quinta década de la vida, representando una incidencia en adultos de 9.1 por millón.[8] Las formas en pacientes jóvenes o pediátricos representan un 20% de la prevalencia total[9] y suelen deberse a una enfermedad hereditaria.[6]
El feocromocitoma es responsable de 0.2 a 0.6% de hipertensión arterial, 0.1-0.6% en adultos, 2-4.5% en niños[9] y 0,3-1,9% de las causas secundarias de hipertensión arterial en la población general.[2] La mayoría son benignos pero un 25% son malignos. 4 -8% son detectados incidentalmente en estudios de imagen. Sin embargo, hasta un 50% son diagnosticados en autopsias y se estima que el porcentaje no diagnosticado es de 0.05% a 0.09%.[6]
La regla del 10 editar
Aunque la regla de los 10, introducida por John Graham en 1951 sigue incluida en libros, hoy en día no es utilizada[10] dado que nuevos estudios han reportado distintas prevalencias.[8]
- 10% de los tumores son malignos
- 10% de las lesiones suprarrenales son bilaterales (inexplicablemente predominan del lado derecho).[11]
- 10% pueden localizarse fuera de las suprarrenales
- 10% de los tumores extraadrenales son intraabdominales[12]
- 10% de los casos tienen un patrón hereditario en el llamado feocromocitoma familiar[13]
- 10% se diagnostican en sujetos normotensos
- 10% aparece en niños
Causas editar
El feocromocitoma es causado por mutaciones en genes de predisposición. Hasta un 70% de los feocromocitomas portan mutaciones, germinales(40%) o somáticas (30%). Un tercio de estas son causadas por mutaciones en el gen VHL. Los genes germinales son: RET, NF1, VHL, succinato deshidrogenasas (SDHA, SDHB, SDHC, SDHD, y SDHAF2), TMEM127, PHD1, PHD2, HIF2A, FH, Factor asociado a Myc (MAX), y KIF1B. Los genes somáticos son: VHL, EPAS1, CSDE1, HRAS, NF1, RET y posiblemente KIF1B. Genéticamente pueden dividirse en 2 tipos: Hereditarios y casos esporádicos.[6]
Hasta ahora se han descubierto 30 genes asociados con los feocromocitomas hereditarios, la mayoría son transmitidos de manera autosómica dominante y forman parte de un síndrome. Los síndromes asociados a feocromocitomas son: Neoplasia endocrina múltiple tipo 2 (MEN2) asociada a mutaciones en RET, Síndrome de Von Hippel-Lindau (VHL) debido a mutaciones en el gen VHL y Neurofibromatosis tipo 1 debido a mutaciones en el gen NF1. El análisis genético de los feocromocitomas ofrece información muy útil para el tamizaje, diagnóstico y pronóstico de los feocromocitomas.[6]
En general pueden ser clasificados en 3 grupos de acuerdo al mapa del genoma del cáncer:
- Hipoxia/pseudohipoxia
- Vía de señalización WNT
- Vía de señalización quinasa
Vía de hipoxia/pseudohipoxia editar
Otto Warburg, fue el primero que identifico las características metabólicas de las células cancerígenas (Fenómeno de Warburg). Las células tumorales dependen de producción anaeróbica de ATP mediante glicólisis, incluso en niveles normales de oxígeno. Usualmente las células bajo hipoxia reaccionan al oxígeno (O2) bajo, llamado respuesta a la hipoxia. El término pseudohipoxia se refiere a la activación de esta respuesta en la presencia de presión parcial de oxígeno (paO2) normal, es caracterizada por un incremento del metabolismo glucolítico y desarrollo de la angiogénesis. La mayoría de tumores del grupo 1 tienen un fenotipo bioquímico de noradrenalina, por lo que producen norepinefrina y dopamina, no epinefrina.[6]
Este grupo se divide en dos subgrupos, el primero está relacionado con mutaciones germinales que afectan el ciclo de Krebs, especialmente las subunidades de la succinato deshidrogenasa (SDHA, SDHB,SDHC, SDHD and SDHAF2), fumarato hidratasa (FH), malato deshidrogenasa 2 (MDH2) y la isocitrato deshidrogenasa (IDH).[9] La mayoría de pacientes con formas hereditarias están asociadas a estas mutaciones y los vinculados a subunidades de SDHx, suelen ser múltiples, agresivos y metastásicos. Debido a mutaciones en estas enzimas la fosforilación en el ciclo de Krebs es interrumpido, aumenta la glicólisis y resulta en la acumulación de succinato, L-malato y fumarato. Estos metabolitos inhiben las enzimas involucradas en la señalización celular y mantenimiento de la cromatina. Así como las enzimas que inhiben el factor inducido por hipoxia, por lo que se activa la vía de hipoxia y la vía de oncogénesis.[6]
El segundo subgrupo envuelve mutaciones en los genes VHL/EPAS1 que contienen mutaciones germinales en PHD1/2 (Egl-9 prolyl hidroxilasa-1 y 2), VHL (Von Hippel-Lindau supresor de tumores) e HIF2A/EPAS1/2 (factor inducido por hipoxia 2 alfa).[9] Debido a una reducción de la hidroxilación y la respuesta celular se producen alteraciones epigenéticas en HIF los involucrados en la angiogénesis, migración, apoptosis, proliferación e invasión tisular. HIF- 2 alfa se estabiliza y acumula lo que resulta en proliferación celular, disminución de la apoptosis y sobre expresión de factor de crecimiento endotelial vascular que incrementa la neo-angiogénesis y sus receptores.[6]
Vía de señalización Wnt editar
Las proteínas Wnt median la comunicación entre células adyacentes o a corta distancia, importantes en el desarrollo, homeostasis tisular, organogénesis, supervivencia celular, migración, polarización y quimiotaxis. Los tumores con mutaciones exclusivas en CSDE1 (Dominio de choque frío E1) o gen somático de fusión UBTF-MAML3 (coactivador transcripcional de las proteínas NOTCH) causan la activación de Wnt y vía de señalización erizo o Hedgehog (Hh).[6] Estos tumores expresan fuertemente cromogranina A, son más agresivos pues la mayoría de pacientes ingresa con recurrencia o metástasis. El fenotipo bioquímico de este grupo es desconocido.[9]
Vía de señalización de quinasa editar
Este grupo está asociado a mutaciones en el protooncogén RET, NF1 (Neurofibromina 1) supresor de tumores, HRAS, TMEM127 (Proteína transmembranal 127), MAX (Factor X asociado a Myc) y KIF1Bβ que provocan la activación anormal de varias vías de señalización ligadas a proteínas parecidas a quinasa, por asociación a Fosfolinositol-3 cinasa PI3K/AKT, RAS/RAF/EDK, mTORC1 (Diana de rapamicina en células de mamífero)/p70S6K (p70S6 quinasa).[9] Por lo que se estimula la proliferación celular, supervivencia celular, desarrollo de cáncer y angiogénesis. Este subtipo ha sido predominantemente observado en feocromocitomas que expresan la enzima fenniletanolamina N- metiltransferasa (PNMT) encontrada principalmente en la medula adrenal y causante de la conversión de nor-adrenalina en adrenalina. Usualmente se detecta sobreproducción de epinefrina y consecuentemente metanefrina.[6]
Fisiopatología editar
Los feocromocitomas liberan un exceso incontrolado de catecolaminas, (norepinefrina, epinefrina y dopamina) que se unen a los receptores de diferentes órganos, causando cambios fisiológicos y efectos orgánicos que pueden resultar en una alta morbi-mortalidad cardiovascular incluyendo arritmias, eventos miocárdicos e infarto.[14]
La norepinefrina estimula los receptores α1, α2 y β1, la epinefrina estimula solo receptores β1 y β2. Los receptores α1 adrenérgicos son localizados principalmente en músculo liso de las arterias periféricas y venas (coronarias, periféricas y renal), su estimulación genera vasoconstricción. Los receptores presinápticos α2 adrenérgicos inhiben la secreción de norepinefrina en los ganglios simpáticos, su estimulación en músculo liso causa vasodilatación arterial y vasoconstricción coronaria. Los receptores β1 se localizan primordialmente en el corazón, provocan un efecto inotrópico y cronotrópico, además aumentan la secreción de renina, resultando en un aumento de la presión arterial. Los receptores β2 provocan vasodilatación de arterias musculoesqueléticas al aumentar la liberación de norepinefrina de las terminales nerviosas simpáticas. La dopamina estimula receptores D1 y D2. D1 causa vasodilatación en las arterias renales, D2 inhibe la secreción de norepinefrina de las terminales nerviosas y tiene un efecto inotrópico negativo en el corazón. Altos niveles de dopamina estimulan receptores α y β1 causando vasoconstricción y aumento de la frecuencia cardiaca.[9]
En los tumores donde predomina la secreción de norepinefrina se provoca una vasoconstricción prolongada con volumen sanguíneo disminuido en la circulación. Mientras que en los que prevalece la epinefrina, la taquiarritmia y la hipertensión son más importantes, además de hipotensión postural debido a la vasodilatación en los músculos esqueléticos. en comparación con los tumores productores de dopamina donde la hipertensión y las palpitaciones pueden no estar presentes.[9]
Los niveles elevados de catecolaminas en plasma aumentan la glucogenólisis e inhibición de la secreción de insulina por lo que pueden encontrar hiperglucemia y otros hallazgos propios de diabetes, también pueden causar cardiomiopatía inducida por estrés (Takotsubo).[14]
Signos y Síntomas editar
La presentación clínica de los Feocromocitomas es muy variable ya que los síntomas son consecuencia de la secreción de catecolaminas por el tumor, por lo que su presentación dependerá del tipo, tamaño, el patrón de secreción de catecolaminas[15], la presión local o metástasis.[6]
Entre el amplio espectro de síntomas que se pueden presentar, se encuentra la tríada clásica:[2]
Se presenta en el 53% de los pacientes, especialmente en los feocromocitomas con sospecha diagnostica.[16] tiene una sensibilidad del 89% y especificidad de 67%, en la presencia de hipertensión 91% y 94% respectivamente.[6]
Los síntomas con la mayor sensibilidad son la hipertensión (80.7%), cefalea (60.4%), palpitaciones (59.3%) y diaforesis (52.4%) hipotensión ortostática 23-50%. Otros síntomas comunes son ansiedad, ataques de pánico[2], palidez, lipotimia y dolor abdominal[16] Con menor frecuencia se puede encontrar fatiga, náusea, perdida de peso, constipación, rubor o sensación caliente, fiebre, temblor, dolor torácico, visión borrosa, papiledema, intolerancia al calor, hiperglicemia, vómitos, cambios electrocardiográficos transitorios, poliuria y polidipsia.[6] asociados a diabetes mellitus.
Los paroxismos son impredecibles pero pueden desencadenarse por situaciones estresantes como la anestesia, manipulación del tumor, comida rica en tiramina y muchos fármacos.[15] Rara vez aparece como una crisis de feocromocitoma, la cual es una condición[6] causada por la secreción incontrolada de catecolaminas caracterizada por falla circulatoria y multiorgánica, fiebre alta, encefalopatía, hipertensión severa o hipotensión.[9]
Hasta un 10-15% de los feocromocitomas son asintomáticos.[15] Actualmente la mayoría (64%) de los feocromocitomas son diagnosticados como incidentalomas (Hallazgos incidentales en estudios de imagen), la tasa de feocromocitomas incidentales aumento de 0% en 1980 a 53% en 2010 -2019.[16] Un 4%[17] se encuentra en las pruebas de mutación familiar y de la línea germinal.[2]
80% de los feocromocitomas incidentales y el 100% de los sospechosos son funcionantes[16] por lo que la presentación de los síntomas también puede variar:
| Síntoma | Incidentalomas | Casos sospechosos | Total |
|---|---|---|---|
| Tríada clásica | 14% | 28% | 17% |
| Síntomas paroxísticos | 49% | 90% | 62% |
| Palpitaciones | 44% | 76% | 53% |
| Ansiedad | 44% | 45% | 46% |
| Sudoración | 39% | 52% | 41% |
| Dolor de cabeza | 29% | 55% | 37% |
| Cansancio | 31% | 28% | 28% |
Los efectos secundarios de la hipertensión prolongada pueden precipitar daño a órganos como el corazón, riñones, ojos, sistema nervioso central y desregulación en el metabolismo de la glucosa. Pueden tener serias consecuencias como isquemia miocárdica, arritmias, falla cardiaca, hemorragia cerebral y muerte repentina.[15] 75% de los pacientes muere por infarto al miocardio o un evento cerebrovascular, aproximadamente 1/3 de las muertes ocurren durante o inmediatamente después de cirugías menores no relacionadas.[6]
Diagnóstico editar
El diagnóstico de feocromocitoma requiere la prueba de secreción excesiva de catecolaminas y documentación anatómica del tumor.[18]
Pruebas bioquímicas editar
Las pruebas bioquímicas son recomendadas y usualmente realizadas antes de estudios imagenológicos. Se realizan principalmente midiendo los niveles de catecolaminas (o sus productos de degradación) en sangre y orina (ácido vainillil mandélico) de 24 horas o los niveles de metanefrinas. Un aumento en plasma de metanefrinas fraccionadas (metanefrina y normetanefrina) tiene un sensibilidad de 97% y una especificidad de 93%. En contraste, la medición de catecolaminas fraccionadas (epinefrina, norepinefrina y dopamina) es menos sensitiva pero valores >2 veces del límite superior también es diagnóstico. La medición en plasma es más sensible y específico, sin embargo; la medición de metanefrinas en orina de 24 horas, ha demostrado una sensibilidad de 97% y especificidad de 91% y es aceptada como una alternativa a las pruebas plasmáticas que tienen una sensibilidad de 97 a 100%.[18]
Los valores definidos para normetanefrinas en plasma van desde 0.47 nmol/l en la niñez hasta 1.05 nmol/l en mayores de 60 años, metanefrinas 0.45 nmol/l y para 3-methoxytiramina 0.10 nmol/l. Los valores hormonales corresponden directamente al tamaño del tumor. Además, los niveles en plasma de CgA son recomendados para el diagnóstico y monitoreo del tratamiento y evolución a largo plazo.[6]
Estudios de imagen editar
Los estudios imagenológicos son importantes para la localización del tumor y la delineación de su extensión.[6] se realizan después de confirmar bioquímicamente el exceso de catecolaminas. Inicialmente se realiza una tomografía computarizada o resonancia magnética del abdomen y pelvis.[18] Los dos tienen sensibilidad similar (87 a 100%)[6] y pueden detectar tumores de 5mm o más. Si el estudio de imagen inicial no localiza el tumor, se indica una resonancia magnética de cuello y tórax.[18]
No obstante en la práctica clínica se pueden presentar 3 diferentes escenarios:
- Síntomas típicos con metanefrinas o catecolaminas elevadas
- Detección incidental de una masa adrenal y retroperitoneal
- Mutación germinal en un gen susceptible en pruebas genéticas y el síndrome asociado.
En el escenario 1, el tumor tiene que localizarse por Tomografía computarizada contrastada o Resonancia magnética en T2.
En el escenario 2 la tomografía computarizada sin contraste es importante, ya que si una masa rica en lípidos está presente, descarta el diagnóstico de feocromocitoma. En masas con 10 unidades de hounsfield, se deben realizar pruebas bioquímicas, si las pruebas bioquímicas son anormales, se debe ejecutar una tomografía computarizada contrastada o resonancia magnética.[2]
En la tomografía computarizada (TC) el feocromocitoma se puede observar clásicamente como una masa bien definida con valores de atenuación, regiones císticas, calcificaciones, fibrosis, necrosis y hemorragia interna.[6]
En la resonancia magnética, las glándulas suprarrenales se pueden delinear en casi todos los pacientes. La imagen clásica del feocromocitoma es una lesión brillante como “bombilla” en la secuencia T2 comparable con la intensidad de la señal del líquido cefalorraquídeo. La resonancia magnética también esta indicada en tumores grandes antes de la cirugía para valorar la invasión vascular y es la modalidad de elección en niños y embarazadas.[6]
Estudio de imagen funcional editar
La indicación principal para una imagen funcional es la búsqueda de enfermedad metastática o la identificación de tumor cromafín múltiple. Son auxiliares en lesiones incidentales fuertemente sospechosas de feocromocitoma con pruebas bioquímicas inconcluyentes y evaluación de extensión regional.[18]
Se efectúa en todos los pacientes con feocromocitomas extra adrenales, metastásicos o múltiples, tumores secretores de norepinefrina y tumores mayores de 5 cm de diámetro secretores de epinefrina. También puede ser ejecutado post cirugía cuando los estudios bioquímicos son inconcluyentes y particularmente cuando el estudio de imagen anatómico es negativo.[6]
Tamizaje editar
Las pruebas de tamizaje son requeridas en pacientes con variabilidad en la presión arterial inexplicada, o en quien muestra presión arterial paroxística en respuesta a una cirugía, anestesia o fármacos, que pueden precipitar síntomas de exceso de catecolaminas en pacientes con feocromocitoma. Se puede considerar el tamizaje en pacientes jóvenes con hipertensión, los que requieren tres o más fármacos para el control, especialmente los que muestran respuesta paradójica con bloqueadores β-adrenérgicos y cualquier paciente con episodios de mareos, sudoración, palidez o ansiedad.[17]
El tamizaje es indicado en pacientes asintomáticos con historia familiar de feocromocitoma o mutaciones germinales asociadas con aumento en el riesgo de feocromocitomas y paragangliomas. En pacientes con mutación en RET (MEN2) y VHL, el tamizaje bioquímico se realiza anualmente con medición de metanefrinas en plasma o en orina de 24 horas a partir de los 5 años. Los pacientes con NF1 deberían de tener tamizaje cada 3 años comenzando de los 10 a los 14 años. Como los niños con mutaciones SDH son silentes bioquímicamente también se recomienda tamizaje imagenológico con RMN cada 18 meses y RMN del cuello , tórax y pelvis cada 3 años.[18]
Desafortunadamente, los valores bioquímicos normales no excluyen feocromocitoma pero la elevación significativa de metanefrinas implica un exceso de epinefrinas, que localiza el tumor en la medula adrenal, lo que puede incrementar la tasa de diagnóstico y tratamiento temprano.[6]
Tratamiento editar
Los feocromocitomas se deben tratar rápidamente una vez identificados.[19] La piedra angular de su tratamiento es la resección quirúrgica.[2]
Preparación prequirúrgica editar
La cirugía de emergencia esta asociada a una mayor mortalidad y morbilidad, por lo que la Sociedad de endocrinología promueve una estabilización inicial de la crisis aguda seguida de un periodo corto (7-14 días) de preparación médica con bloqueadores α-adrenérgicos para controlar la presión arterial, minimizar las complicaciones prequirúrgicas y prevenir crisis hipertensivas transquirurgicas.[19] El manejo médico prolongado antes de la cirugía es posible y efectivo en pacientes con feocromocitoma, síntomas moderados y con un buen control de la presión arterial en caso de ser necesario retrasar el tratamiento definitivo.[20]
La meta es mantener presiones arteriales <130/80 mmHg sentados y >80/45 mmhg en bipedestación. El objetivo de frecuencia cardiaca es 60-70 lpm (latidos por minuto) sentados y 70-80 lpm en bipedestación. Si la presión arterial del paciente no puede ser controlada por el bloqueo adrenérgico, se puede agregar bloqueadores de canales de calcio. El inhibidor de la tirosina hidrolasa metirosina, que inhibe la síntesis de catecolaminas, se puede administrar en pacientes que no toleran los α-bloqueadores o en hipertensión que no es controlada con α-bloqueadores y/o bloqueadores de canales de calcio. Información reciente sugiere que el uso de metirosina en combinación con fenoxibenzamina preoperatoria podría reducir la inestabilidad hemodinámica y los problemas cardiovasculares postoperatorios. Si el pulso es mayor a 100 lpm 3 a 4 días después del α-bloqueo, es necesario administrar β-bloqueadores para controlar la taquicardia.[20]
El bloqueo adrenérgico debe de acompañarse de una dieta alta en sodio (5000 mg/día)y consumo adecuado de líquidos (2.5 L/día)[2] para prevenir hipotensión severa después de la eliminación del tumor. Otra opción es administrar 1-2 L de solución salina (0.9%) intravenosa un día antes de la cirugía.[20]
Adrenalectomía editar
El tratamiento más importante es la cirugía, ya que ofrece la mejor posibilidad de curación o remisión. La cirugía adrenal puede realizarse de forma laparoscópica o abierta. La elección de la terapia depende del diámetro y el tipo de lesión, las características del paciente y la experiencia o preferencia del cirujano.[20]
La adrenalectomía laparoscópica se ha convertido en el tratamiento estandarizado para pacientes candidatos debido a su corto tiempo operatorio, menores complicaciones postoperatorias y estancia hospitalaria.[19]
Sin embargo, la adrenalectomía abierta sigue siendo la recomendada para proveer resección completa del tumor, prevenir la ruptura del tumor y recurrencia en feocromocitomas mayores a 6 cm, es preferida en pacientes con lesiones multifocales donde el abordaje laparoscópico no es posible.[20]
La principal complicación postoperatoria son la hipotensión e hipoglicemia por lo que los pacientes deben de permanecer en observación por 24 a 48 horas.13 En caso de presentarse hipotensión se deberá administrar solución salina 0.9% o si es necesario bolos o infusión de epinefrina o fenilefrina.[20]
Tumor metastásico editar
Los sitios de metástasis típicos son huesos y ganglios linfáticos. Las opciones para un feocromocitoma metastásico incluye la resección quirúrgica, el uso de portadores radiomarcados dirigidos, ablación, quimioterapia e irradiación externa.[2]
Seguimiento editar
Se recomienda un seguimiento de por lo menos 10 años en todos los pacientes con historia de feocromocitoma para detectar recurrencia local, metastásica o la aparición de nuevos tumores. El seguimiento de por vida es recomendado en pacientes con alto riesgo (mutaciones germinales, menores de 20 años, tumor > 5 cm, y portadores de SDHB).[20]
Véase también editar
Referencias editar
- ↑ Sisson, J. C; Shulkin, B. L; Esfandiari, N. H (1 de agosto de 2006). «Courses of Malignant Pheochromocytoma: Implications for Therapy». Annals of the New York Academy of Sciences (en inglés) 1073 (1): 505-511. ISSN 0077-8923. doi:10.1196/annals.1353.053. Consultado el 24 de julio de 2022.
- ↑ a b c d e f g h i j k l Neumann, Hartmut P.H.; Young, William F.; Eng, Charis (8 de agosto de 2019). «Pheochromocytoma and Paraganglioma». En Longo, Dan L., ed. New England Journal of Medicine (en inglés) 381 (6): 552-565. ISSN 0028-4793. doi:10.1056/NEJMra1806651. Consultado el 5 de julio de 2022.
- ↑ Mubarik, Ateeq; Aeddula, Narothama R. (2022). Chromaffin Cell Cancer. StatPearls Publishing. Consultado el 14 de julio de 2022.
- ↑ a b Román González, A., Builes Barrera, C. A., Gutiérrez, J., & Román-González, A. (2016). «El primer caso de feocromocitoma». Rev Col Endocrinol Diab Metab, 3(2).
- ↑ a b «Validate User». academic.oup.com. doi:10.1210/js.2017-00208. Consultado el 5 de julio de 2022.
- ↑ a b c d e f g h i j k l m n ñ o p q r s t u Farrugia, Frederick-Anthony; Charalampopoulos, Anestis (1 de julio de 2019). «Pheochromocytoma». Endocrine Regulations (en inglés) 53 (3): 191-212. ISSN 1336-0329. doi:10.2478/enr-2019-0020. Consultado el 5 de julio de 2022.
- ↑ Manger, W. M (1 de agosto de 2006). «An Overview of Pheochromocytoma: History, Current Concepts, Vagaries, and Diagnostic Challenges». Annals of the New York Academy of Sciences (en inglés) 1073 (1): 1-20. ISSN 0077-8923. doi:10.1196/annals.1353.001. Consultado el 5 de julio de 2022.
- ↑ a b Farrugia, Frederick-Anthony; Charalampopoulos, Anestis (1 de julio de 2019). «Pheochromocytoma». Endocrine Regulations (en inglés) 53 (3): 191-212. ISSN 1336-0329. doi:10.2478/enr-2019-0020. Consultado el 5 de julio de 2022.
- ↑ a b c d e f g h i Aygun, Nurcihan (2020). «Pheochromocytoma and paraganglioma: from epidemiology to clinical findings». SiSli Etfal Hastanesi Tip Bulteni / The Medical Bulletin of Sisli Hospital (en inglés) 54 (2). ISSN 1302-7123. PMC 7326683. PMID 32617052. doi:10.14744/semb.2020.18794. Consultado el 5 de julio de 2022.
- ↑ Aygun, Nurcihan (2020). «Pheochromocytoma and paraganglioma: from epidemiology to clinical findings». SiSli Etfal Hastanesi Tip Bulteni / The Medical Bulletin of Sisli Hospital (en inglés) 54 (2). ISSN 1302-7123. PMC 7326683. PMID 32617052. doi:10.14744/semb.2020.18794. Consultado el 5 de julio de 2022.
- ↑ COPO JORGE, José A, SAVIO LÓPEZ, Andrés M, SOLIVA DOMÍNGUEZ, Ramón et al. Feocromocitoma: diagnóstico y resultados del tratamiento quirúrgico. Rev Cubana Cir, Mayo-ago. 2002, vol.41, no.2, p.98-103. ISSN 0034-7493. [1]
- ↑ Universidad de Guadalajara, Centro Universitario de Ciencias de la Salud. [2] Archivado el 31 de diciembre de 2006 en Wayback Machine.
- ↑ University of Bonn Medical Center. [3] Archivado el 14 de junio de 2007 en Wayback Machine.
- ↑ a b Patel, Dhaval; Phay, John E.; Yen, Tina W. F.; Dickson, Paxton V.; Wang, Tracy S.; Garcia, Roberto; Yang, Anthony D.; Solórzano, Carmen C. et al. (1 de mayo de 2020). «Update on Pheochromocytoma and Paraganglioma from the SSO Endocrine/Head and Neck Disease-Site Work Group. Part 1 of 2: Advances in Pathogenesis and Diagnosis of Pheochromocytoma and Paraganglioma». Annals of Surgical Oncology (en inglés) 27 (5): 1329-1337. ISSN 1534-4681. PMC 8655649. PMID 32112212. doi:10.1245/s10434-020-08220-3. Consultado el 8 de julio de 2022.
- ↑ a b c d Sbardella, Emilia; Grossman, Ashley B. (2020-03). «Pheochromocytoma: An approach to diagnosis». Best Practice & Research Clinical Endocrinology & Metabolism (en inglés) 34 (2): 101346. doi:10.1016/j.beem.2019.101346. Consultado el 14 de julio de 2022.
- ↑ a b c d Uslar, Thomas; San Francisco, Ignacio F; Olmos, Roberto; Macchiavelo, Stefano; Zuñiga, Alvaro; Rojas, Pablo; Garrido, Marcelo; Huete, Alvaro et al. (1 de octubre de 2021). «Clinical Presentation and Perioperative Management of Pheochromocytomas and Paragangliomas: A 4-Decade Experience». Journal of the Endocrine Society 5 (10): bvab073. ISSN 2472-1972. PMC 8336720. PMID 34377881. doi:10.1210/jendso/bvab073. Consultado el 14 de julio de 2022.
- ↑ a b c Falhammar, Henrik; Kjellman, Magnus; Calissendorff, Jan (1 de enero de 2018). «Initial clinical presentation and spectrum of pheochromocytoma: a study of 94 cases from a single center». Endocrine Connections (en inglés estadounidense) 7 (1): 186-192. ISSN 2049-3614. PMC 5776668. PMID 29217652. doi:10.1530/EC-17-0321. Consultado el 14 de julio de 2022.
- ↑ a b c d e f Jain, Amrish; Baracco, Rossana; Kapur, Gaurav (1 de abril de 2020). «Pheochromocytoma and paraganglioma—an update on diagnosis, evaluation, and management». Pediatric Nephrology (en inglés) 35 (4): 581-594. ISSN 1432-198X. doi:10.1007/s00467-018-4181-2. Consultado el 14 de julio de 2022.
- ↑ a b c Japp, Emily A; Leiter, Amanda; Tsomos, Effie A; Reda, Sarah A; Levine, Alice C (1 de febrero de 2021). «Management of 3 Cases of Pheochromocytoma During the COVID-19 Pandemic in New York City: Lessons Learned». Journal of the Endocrine Society (en inglés) 5 (2): bvaa198. ISSN 2472-1972. PMC 7796773. PMID 33447692. doi:10.1210/jendso/bvaa198. Consultado el 15 de julio de 2022.
- ↑ a b c d e f g Aygun, Nurcihan (2020). «Pheochromocytoma and paraganglioma: from treatment to follow-up». SiSli Etfal Hastanesi Tip Bulteni / The Medical Bulletin of Sisli Hospital. doi:10.14744/SEMB.2020.58998. Consultado el 15 de julio de 2022.