Acetaldehído
El etanal o acetaldehído es un compuesto orgánico de fórmula CH3CHO. Es un líquido volátil, incoloro y con un olor característico ligeramente afrutado. Es un metabolito hepático del etanol y principal factor para la aparición de la resaca alcohólica y el rubor facial. Es 20 veces más tóxico que el alcohol, y altamente cancerígeno[2] pudiendo dañar tanto al ADN como a las proteínas.[3]
| Acetaldehído | ||
|---|---|---|
 | ||
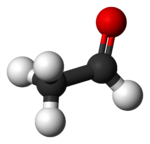 | ||
| Nombre IUPAC | ||
| Etanal | ||
| General | ||
| Otros nombres |
Acetaldehído Aldehído acético Aldehído etílico | |
| Fórmula semidesarrollada | CHO-CH3 | |
| Fórmula estructural | ver imagen | |
| Fórmula molecular | C2H4O | |
| Identificadores | ||
| Número CAS | 75-07-0[1] | |
| ChEBI | 15343 | |
| ChEMBL | CHEMBL170365 | |
| ChemSpider | 172 | |
| PubChem | 177 | |
| UNII | GO1N1ZPR3B | |
| KEGG | C00084 | |
| Propiedades físicas | ||
| Densidad | 788 kg/m³; 0,788 g/cm³ | |
| Masa molar | 4405 g/mol | |
| Punto de fusión | 150 K (−123 °C) | |
| Punto de ebullición | 293 K (20 °C) | |
| Viscosidad | ~0,215 | |
| Índice de refracción (nD) | 1,3316 | |
| Propiedades químicas | ||
| Solubilidad en agua | completamente miscible | |
| Momento dipolar | 2,7 D | |
| Familia | Aldehídos | |
| Peligrosidad | ||
| SGA |
   | |
| Punto de inflamabilidad | 234,15 K (−39 °C) | |
| NFPA 704 |
4
3
2
| |
| Temperatura de autoignición | 458,15 K (185 °C) | |
| Frases R | R12, R36/37, R40 | |
| Frases S | S2, S16, S33, S36/37 | |
| Límites de explosividad | 4.5 - 57 % Vol en aire | |
| Compuestos relacionados | ||
| Aldehídos |
Formaldehído Propionaldehído | |
| Otros compuestos | Óxido de etileno | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Datos fisicoquímicos
editar- Concentración máxima permitida en lugares de trabajo: 50 ppm (90 mg/m³)
Síntesis
editarTécnicamente se obtiene el etanal por hidratación del acetileno en presencia de sales de mercurio (II):
En el laboratorio se puede obtener mediante la oxidación de etanol. Se forma por ejemplo con dicromato de potasio, reacción que es utilizada en la detección del etanol en el aire espirado.
Historia
editarEl acetaldehído fue sintetizado por primera vez en el año de 1782 por Scheele mediante la oxidación de etanol con dióxido de manganeso (MnO2). Su fórmula fue averiguada por primera vez por von Liebig en 1835 que le dio el nombre de acetaldehído
Aplicaciones
editarEn presencia de ácidos el acetaldehído forma oligómeros. El trímero (paraldehído) ha sido utilizado de somnífero. El tetrámero se utiliza como combustible sólido.
El etanal es producto de partida en la síntesis de plásticos, pinturas, lacas, en la industria del caucho, de papel y la curtición del cuero. Incluso se utiliza como conservante de carnes u otros productos alimenticios.
Toxicología
editarLa oxidación del etanol a etanal en el metabolismo del cuerpo humano se considera como principal factor para la aparición de la resaca tras la ingesta de bebidas alcohólicas, también provoca varios efectos negativos sobre el organismo, por lo que el mismo intenta eliminarlo a través de la piel, el aliento, la metabolización hepática y la excreción del compuesto a través de la orina. El etanal también se transforma en grasa en la parte abdominal del cuerpo, lo cual provoca obesidad en personas que son consumidoras de cerveza en forma frecuente, esto es coloquialmente conocido como «barriga cervecera».
En efecto, en realidad el etanal es el verdadero responsable de la ebriedad con su correspondiente resaca.
Véase también
editarReferencias
editar- ↑ Número CAS
- ↑ «ARC MONOGRAPHS ON THE EVALUATION OF CARCINOGENIC RISKS TO HUMANS».
- ↑ «Alcohol y el riesgo de cáncer». National Cancer Institute. Consultado el 5 de junio de 2016.
Enlaces externos
editar- Wikimedia Commons alberga una categoría multimedia sobre Acetaldehído.
- Wikcionario tiene definiciones y otra información sobre acetaldehído.
