Fagocitosis
La fagocitosis (del griego phagein, "comer", y kytos, 'célula') es el proceso por el cual una célula utiliza su membrana plasmática para engullir una partícula grande (≥ 0,5 μm), dando lugar a un compartimento interno llamado fagosoma. Es un tipo de endocitosis. Una célula que realiza la fagocitosis se llama fagocito.


| Transporte de membrana | ||
|---|---|---|
| Mecanismos de transporte químico a través de membranas biológicas | ||
 | ||
| Transporte pasivo |
| |
| Transporte activo | ||
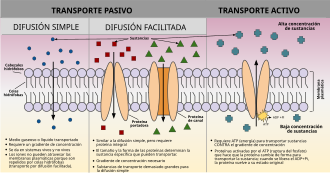
| Citosis | ||
| Endocitosis | ||
| Exocitosis |
| |
| Otras formas de transporte anexas son: el Transporte paracelular y el Transporte transcelular. Su movimiento opuesto se conoce como Transporte inverso. | ||


En el sistema inmunitario de un organismo multicelular, la fagocitosis es un mecanismo importante que se utiliza para eliminar patógenos y desechos celulares. El material ingerido luego se digiere en el fagosoma. Las bacterias, las células muertas de los tejidos y las pequeñas partículas minerales son ejemplos de objetos que se pueden fagocitar. Algunos protozoos utilizan la fagocitosis como medio para obtener nutrientes.
Historia editar
La fagocitosis fue observada por primera vez por el médico canadiense William Osler (1876),[1] y luego estudiada y nombrada por Élie Metchnikoff (1880, 1883).[2]
En el sistema inmunológico editar
La fagocitosis es uno de los principales mecanismos de la defensa inmunitaria innata. Es uno de los primeros procesos que responde a la infección y también es una de las ramas iniciadoras de una respuesta inmunitaria adaptativa. Aunque la mayoría de las células son capaces de fagocitosis, algunos tipos de células la realizan como parte de su función principal. Estos se llaman 'fagocitos profesionales'. La fagocitosis es antigua en términos evolutivos, estando presente incluso en invertebrados.[3]
Células fagocíticas profesionales editar
Los neutrófilos, macrófagos, monocitos, células dendríticas, osteoclastos y eosinófilos pueden clasificarse como fagocitos profesionales.[2] Los primeros tres tienen el papel más importante en la respuesta inmune a la mayoría de las infecciones.[3]
El papel de los neutrófilos es patrullar el torrente sanguíneo y migrar rápidamente a los tejidos en grandes cantidades solo en caso de infección.[3] Allí tienen efecto microbicida directo por fagocitosis. Después de la ingestión, los neutrófilos son eficientes en la destrucción intracelular de patógenos. Los neutrófilos fagocitan principalmente a través de los receptores Fcγ y los receptores del complemento 1 y 3. El efecto microbicida de los neutrófilos se debe a un gran repertorio de moléculas presentes en los gránulos preformados. Las enzimas y otras moléculas preparadas en estos gránulos son proteasas, como colagenasa, gelatinasa o serina proteasas, mieloperoxidasa, lactoferrina y proteínas antibióticas. La desgranulación de estos en el fagosoma, acompañada de una alta producción de especies reactivas de oxígeno (explosión oxidativa) es altamente microbicida.[4]
Los monocitos y los macrófagos que maduran a partir de ellos abandonan la circulación sanguínea para migrar a través de los tejidos. Allí son células residentes y forman una barrera de reposo.[3] Los macrófagos inician la fagocitosis por los receptores de manosa, los receptores depuradores, los receptores Fcγ y los receptores del complemento 1, 3 y 4. Los macrófagos son longevos y pueden continuar la fagocitosis formando nuevos lisosomas.[3][5]
Las células dendríticas también residen en los tejidos e ingieren patógenos por fagocitosis. Su papel no es matar o eliminar microbios, sino descomponerlos para la presentación de antígenos a las células del sistema inmunitario adaptativo.[3]
Receptores de iniciación editar
Los receptores para la fagocitosis se pueden dividir en dos categorías por moléculas reconocidas. Los primeros, los receptores opsónicos, dependen de las opsoninas.[6] Entre estos están los receptores que reconocen la parte Fc de los anticuerpos IgG unidos, el complemento depositado o los receptores que reconocen otras opsoninas de origen celular o plasmático. Los receptores no opsónicos incluyen receptores de tipo lectina, receptores de dectina o receptores carroñeros. Algunas vías fagocíticas requieren una segunda señal de los receptores de reconocimiento de patrones (PRR) activados por la unión a patrones moleculares asociados a patógenos (PAMPS), lo que conduce a la activación de NF-κB.[2]
Receptores Fcγ editar
Los receptores Fcγ reconocen objetivos recubiertos de IgG. La parte principal reconocida es el fragmento Fc. La molécula del receptor contiene un dominio ITAM intracelular o se asocia con una molécula adaptadora que contiene ITAM. Los dominios ITAM transducen la señal desde la superficie del fagocito hasta el núcleo. Por ejemplo, los receptores activadores de macrófagos humanos son FcγRI, FcγRIIA y FcγRIII.[5] La fagocitosis mediada por el receptor Fcγ incluye la formación de protuberancias de la célula llamadas "copa fagocítica" y activa un estallido oxidativo en los neutrófilos.[4]
Receptores del complemento editar
Estos receptores reconocen dianas recubiertas de C3b, C4b y C3bi del complemento plasmático. El dominio extracelular de los receptores contiene un dominio de unión al complemento similar a la lectina. El reconocimiento por parte de los receptores del complemento no es suficiente para provocar la internalización sin señales adicionales. En los macrófagos, CR1, CR3 y CR4 son responsables del reconocimiento de objetivos. Los objetivos recubiertos con complemento se internalizan 'hundiéndose' en la membrana del fagocito, sin protuberancias.[5]
Receptores de manosa editar
La manosa y otros azúcares asociados a patógenos, como la fucosa, son reconocidos por el receptor de manosa. Ocho dominios similares a lectina forman la parte extracelular del receptor. La ingestión mediada por el receptor de manosa es distinta en mecanismos moleculares de la fagocitosis mediada por el receptor Fcγ o el receptor del complemento.[5]
Fagosoma editar
La absorción de material es facilitada por el sistema contráctil actina-miosina. El fagosoma es el orgánulo formado por fagocitosis de material. Luego se mueve hacia el centrosoma del fagocito y se fusiona con los lisosomas, formando un fagolisosoma y provocando la degradación. Progresivamente, el fagolisosoma se acidifica, activando enzimas degradantes.[2][7]
La degradación puede ser dependiente del oxígeno o independiente del oxígeno.
- La degradación dependiente del oxígeno depende del NADPH y de la producción de especies reactivas de oxígeno. El peróxido de hidrógeno y la mieloperoxidasa activan un sistema de halogenación que conduce a la creación de hipoclorito y la destrucción de bacterias.[8]
- La degradación independiente del oxígeno depende de la liberación de gránulos que contienen enzimas como las lisozimas y proteínas catiónicas como las defensinas. Otros péptidos antimicrobianos están presentes en estos gránulos, incluida la lactoferrina, que secuestra el hierro para proporcionar condiciones de crecimiento desfavorables para las bacterias. Otras enzimas como la hialuronidasa, la lipasa, la colagenasa, la elastasa, la ribonucleasa y la desoxirribonucleasa también desempeñan un papel importante en la prevención de la propagación de infecciones y la degradación de biomoléculas microbianas esenciales que conducen a la muerte celular.[4][5]
Los leucocitos generan cianuro de hidrógeno durante la fagocitosis y pueden matar bacterias, hongos y otros patógenos al generar otras sustancias químicas tóxicas.[9][10][11]
Algunas bacterias, por ejemplo Treponema pallidum, Escheria coli y Staphylococcus aureus, son capaces de evitar la fagocitosis por varios mecanismos.
En apoptosis editar
Después de la apoptosis, los macrófagos deben absorber las células moribundas en los tejidos circundantes en un proceso llamado eferocitosis. Una de las características de una célula apoptótica es la presentación de una variedad de moléculas intracelulares en la superficie celular, como calreticulina, fosfatidilserina (de la capa interna de la membrana plasmática), anexina A1, LDL oxidada y glicanos alterados.[12] Estas moléculas son reconocidas por receptores en la superficie celular del macrófago, como el receptor de fosfatidilserina, o por receptores solubles (flotantes libres), como trombospondina 1, GAS6 y MFGE8, que luego se unen a otros receptores en el macrófago, como CD36 e integrina alfa-v beta-3. Los defectos en la eliminación de células apoptóticas generalmente se asocian con fagocitosis alterada de macrófagos. La acumulación de restos de células apoptóticas a menudo provoca trastornos autoinmunes; por tanto, la potenciación farmacológica de la fagocitosis tiene un potencial médico en el tratamiento de ciertas formas de trastornos autoinmunes.[13][14][15][16]
En protistas editar
En muchos protistas, la fagocitosis se utiliza como medio de alimentación, proporcionando parte o la totalidad de su nutrición. Esto se denomina nutrición fagotrófica, a diferencia de la nutrición osmotrófica que tiene lugar por absorción.
- En algunos, como la ameba, la fagocitosis tiene lugar rodeando el objeto objetivo con seudópodos, como en los fagocitos animales. En humanos, el amebozoo Entamoeba histolytica puede fagocitar glóbulos rojos.
- Los ciliados también participan en la fagocitosis.[17] En los ciliados hay un surco o cámara especializada en la célula donde tiene lugar la fagocitosis, llamada citostoma o boca.
Al igual que en las células inmunitarias fagocíticas, el fagosoma resultante puede fusionarse con lisosomas (vacuolas alimenticias) que contienen enzimas digestivas, formando un fagolisosoma. Luego, las partículas de alimentos se digieren y los nutrientes liberados se difunden o transportan al citosol para su uso en otros procesos metabólicos.[18]
La mixotrofia puede involucrar nutrición fagotrófica y nutrición fototrófica.[19]
Véase también editar
Referencias editar
- ↑ Ambrose, Charles T. (2006). «The Osler slide, a demonstration of phagocytosis from 1876: Reports of phagocytosis before Metchnikoff's 1880 paper». Cellular Immunology 240 (1): 1-4. PMID 16876776. doi:10.1016/j.cellimm.2006.05.008.
- ↑ a b c d Gordon, Siamon (15 de marzo de 2016). «Phagocytosis: An Immunobiologic Process». Immunity 44 (3): 463-475. ISSN 1097-4180. PMID 26982354. doi:10.1016/j.immuni.2016.02.026.
- ↑ a b c d e f Travers, Paul; Walport, Mark; Janeway, Charles (2012). Janeway's immunobiology (8th ed edición). Garland Science. ISBN 978-0-8153-4243-4. OCLC 733935898.
- ↑ a b c Witko-Sarsat, V.; Rieu, P.; Descamps-Latscha, B.; Lesavre, P.; Halbwachs-Mecarelli, L. (2000-05). «Neutrophils: molecules, functions and pathophysiological aspects». Laboratory Investigation; a Journal of Technical Methods and Pathology 80 (5): 617-653. ISSN 0023-6837. PMID 10830774. doi:10.1038/labinvest.3780067.
- ↑ a b c d e Aderem, A.; Underhill, D. M. (1999). «Mechanisms of phagocytosis in macrophages». Annual Review of Immunology 17: 593-623. ISSN 0732-0582. PMID 10358769. doi:10.1146/annurev.immunol.17.1.593.
- ↑ Janeway, Charles. Based on (2015). The immune system (Fourth edition edición). ISBN 978-0-8153-4466-7. OCLC 882738826.
- ↑ Flannagan, Ronald S.; Jaumouillé, Valentin; Grinstein, Sergio (2012). «The cell biology of phagocytosis». Annual Review of Pathology 7: 61-98. ISSN 1553-4014. PMID 21910624. doi:10.1146/annurev-pathol-011811-132445.
- ↑ Hemilä, H. (1992-01). «Vitamin C and the common cold». The British Journal of Nutrition 67 (1): 3-16. ISSN 0007-1145. PMID 1547201. doi:10.1079/bjn19920004.
- ↑ Borowitz, J. L.; Gunasekar, P. G.; Isom, G. E. (12 de septiembre de 1997). «Hydrogen cyanide generation by mu-opiate receptor activation: possible neuromodulatory role of endogenous cyanide». Brain Research 768 (1-2): 294-300. ISSN 0006-8993. PMID 9369328. doi:10.1016/s0006-8993(97)00659-8.
- ↑ Stelmaszyńska, T. (1985). «Formation of HCN by human phagocytosing neutrophils--1. Chlorination of Staphylococcus epidermidis as a source of HCN». The International Journal of Biochemistry 17 (3): 373-379. ISSN 0020-711X. PMID 2989021. doi:10.1016/0020-711x(85)90213-7.
- ↑ Zgliczyński, Jan Maciej; Stelmaszyńska, Teresa (1988). Sbarra, Anthony J., ed. The Respiratory Burst of Neutrophilic Granulocytes and Its Influence on Infected Tissues (en inglés). Springer US. pp. 315-347. ISBN 978-1-4684-5496-3. doi:10.1007/978-1-4684-5496-3_15.
- ↑ Bilyy, Rostyslav O.; Shkandina, Tanya; Tomin, Andriy; Muñoz, Luis E.; Franz, Sandra; Antonyuk, Volodymyr; Kit, Yuriy Ya.; Zirngibl, Matthias et al. (2012-01). «Macrophages Discriminate Glycosylation Patterns of Apoptotic Cell-derived Microparticles». Journal of Biological Chemistry 287 (1): 496-503. ISSN 0021-9258. PMC 3249103. PMID 22074924. doi:10.1074/jbc.m111.273144.
- ↑ Mukundan, Lata; Odegaard, Justin I.; Morel, Christine R.; Heredia, Jose E.; Mwangi, Julia W.; Ricardo-Gonzalez, Roberto R.; Goh, Y. P. Sharon; Eagle, Alex Red et al. (2009-11). «PPAR-δ senses and orchestrates clearance of apoptotic cells to promote tolerance». Nature Medicine (en inglés) 15 (11): 1266-1272. ISSN 1546-170X. PMC 2783696. PMID 19838202. doi:10.1038/nm.2048.
- ↑ Roszer, T; Menéndez-Gutiérrez, MP; Lefterova, MI; Alameda, D; Núñez, V; Lazar, MA; Fischer, T; Ricote, M (Jan 1, 2011). «Autoimmune kidney disease and impaired engulfment of apoptotic cells in mice with macrophage peroxisome proliferator-activated receptor gamma or retinoid X receptor alpha deficiency». Journal of Immunology 186 (1): 621-31. PMC 4038038. PMID 21135166. doi:10.4049/jimmunol.1002230.
- ↑
- ↑ Han, CZ; Ravichandran, KS (Dec 23, 2011). «Metabolic connections during apoptotic cell engulfment». Cell 147 (7): 1442-5. PMC 3254670. PMID 22196723. doi:10.1016/j.cell.2011.12.006.
- ↑ Grønlien, Heidi K.; Berg, Trond; Løvlie, Arne M. (2002-07). «In the polymorphic ciliate Tetrahymena vorax, the non-selective phagocytosis seen in microstomes changes to a highly selective process in macrostomes». The Journal of Experimental Biology 205 (Pt 14): 2089-2097. ISSN 0022-0949. PMID 12089212. doi:10.1242/jeb.205.14.2089.
- ↑ Montagnes, David J. S.; Barbosa, Ana B.; Boenigk, Jens; Davidson, Keith; Jürgens, Klaus; Macek, Miroslav; Parry, Jacqueline D.; Roberts, Emily C. et al. (18 de septiembre de 2008). «Selective feeding behaviour of key free-living protists: avenues for continued study». Aquatic Microbial Ecology (en inglés) 53 (1): 83-98. ISSN 0948-3055. doi:10.3354/ame01229.
- ↑ Stibor, Herwig; Sommer, Ulrich (2003-04). «Mixotrophy of a photosynthetic flagellate viewed from an optimal foraging perspective». Protist 154 (1): 91-98. ISSN 1434-4610. PMID 12812372. doi:10.1078/143446103764928512.
Enlaces externos editar
- Media related to Phagocytosis at Wikimedia Commons
- MeSH: Phagocytosis (en inglés)