Hemo B
Un hemo B o heme B (también conocido como protohemo IX) es el más abundante de los grupos hemo, tanto la hemoglobina como la mioglobina son ejemplos de proteínas transportadoras de oxígeno que contienen hemo B. Las proteínas de la familia de las peroxidasas también contienen hemo B. Las enzimas cicloxigenasas COX-1 y COX-2, también contienen hemo B en uno de sus dos sitios activos.
| Hemo B | ||
|---|---|---|
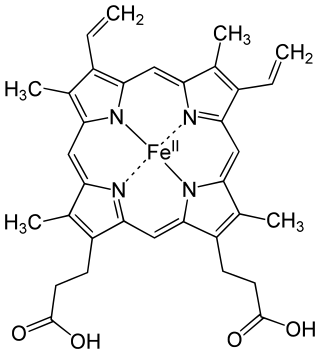 | ||
 | ||
| General | ||
| Fórmula molecular |
C 34H 32O 4N 4Fe | |
| Identificadores | ||
| Número CAS | 14875-96-8[1] | |
| ChEBI | 26355 | |
| ChemSpider | 16739950 | |
| DrugBank | DB18267 | |
| PubChem | 444098 | |
| UNII | 42VZT0U6YR | |
| KEGG | C00032 | |
|
OC(=O)CC/C6=C(\C)/C=3/N=C6/C=C2/C(/CCC(O)=O)=C(/C)\C1=C\C5=N\C(=C/c4n([Fe]N12)c(C=3)c(C=C)c4C)C(\C=C)=C5\C
| ||
|
InChI=1S/C34H34N4O4.Fe/c1-7-21-17(3)25-13-26-19(5)23(9-11-33(39)40)31(37-26)16-32-24(10-12-34(41)42)20(6)28(38-32)15-30-22(8-2)18(4)27(36-30)14-29(21)35-25;/h7-8,13-16H,1-2,9-12H2,3-6H3,(H4,35,36,37,38,39,40,41,42);/q;+2/p-2/b25-13-,26-13-,27-14-,28-15-,29-14-,30-15-,31-16-,32-16-;
Key: KABFMIBPWCXCRK-RGGAHWMASA-L | ||
| Propiedades físicas | ||
| Masa molar | 616 487 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Estructura
editarGeneralmente, el hemo B se encuentra encajado en la matriz proteica que lo rodea (conocida como apoenzima), por medio de un único enlace coordinado entre el hierro del heme y una cadena lateral de aminoácido.
Tanto la hemoglobina como la mioglobina poseen un enlace de coordinación formado por una histidina evolutivamente muy conservada, mientras que en la óxido nítrico sintasa y en citocromo p450 el enlace se encuentra formado por una cisteína también muy conservada evolutivamente, unida al centro del hemo B.
Debido a que en las proteínas que contienen al grupo hemo B, el hierro se encuentra unido a cuatro nitrógenos del anillo porfirina formando una estructura plana, y a un único átomo donante de un par electrónico proveniente de la proteína; este hierro se encuentra en un estado pentacoordinado, teniendo el sexto sitio de coordinación libre para unir otro ligando. Esto las convierte en excelentes mecanismos para transportar otras moléculas pequeñas. Permitiendo por ejemplo que el oxígeno o la molécula tóxica monóxido de carbono se unan al sitio libre, alcanzando el estado de hexacoordinación del hierro.
Véase también
editarReferencias
editar