Imina
Una imina es un grupo funcional o compuesto orgánico con estructura general RR'C=NR'', donde R'' puede ser un H o un grupo orgánico, siendo en este último caso conocida también como base de Schiff.[1][2]
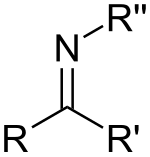
Las iminas son el producto de condensación del amoníaco o una amina primaria con una cetona o un aldehído.
De forma análoga al doble enlace de los alquenos, las iminas pueden presentar isomería Z/E. Cabe esperar que los criterios de estabilidad relativa de un isómero respecto al otro sean los mismos que con los alquenos (impedimento estérico).
Al igual que la tautomería ceto-enólica, también existe la tautomería imina-enamina con predominio de la primera (la imina).
Síntesis
editarEl mecanismo de formación de la imina, de manera simplificada, comienza con la adición nucleófila de la amina sobre el carbonilo electrófilo del aldehído o cetona, formándose un hemiaminal como intermedio, el cual a continuación pierde una molécula de agua para conducir a la imina.
La reacción habitualmente requiere catálisis ácida. Además al ser una reacción de equilibrio para desplazarla hacia producto hay que eliminar el agua del medio de reacción azeotrópicamente o mediante agentes deshidratantes.
La formación de iminas está favorecida cuando existe conjugación del doble enlace carbono-nitrógeno con algún sustituyente, típicamente grupos arilo. En estos casos la imina es relativamente estable.
Reacciones
editar- La imina puede ser reducida a amina (aminación reductora).
- La imina puede ser hidrolizada con agua a los correspondientes compuestos carbonilo y amina.
- La imina reacciona con más amina a un aminal.
- La imina reacciona con CN- en la síntesis de Strecker de aminoácidos.
- Las sales de iminio resultantes de la protonación de iminas pueden ser intermedios, reaccionando con nucleófilos de tipo enol, en la reacción de Knoevenagel y en la reacción de Mannich.
- Esta reacción es un paso crucial en la síntesis de diversos heterociclos, tales como Síntesis de pirroles de Hantzsch, Síntesis de indoles de Bischler-Möhlau, Síntesis de indoles de Nenitzescu, Síntesis de piridina de Hantzsch, síntesis de piridonas de Guareschi-Thorpe, Síntesis de quinolinas de Conrad-Limpach, Síntesis de quinolinas de Doebner, Síntesis de tetrahidroisoquinolinas de Pictet-Spengler, Reacción de Pictet-Spengler, Síntesis de isoquinolinas de Pomeranz-Fritsch, Síntesis de imidazoles de Debus-Radziszewski, Síntesis de Staedel-Rugheimer, Síntesis de Gutknecht, síntesis de quinoxalinas.
Véase también
editarReferencias
editar- ↑ IUPAC Compendium of Chemical Terminology, Electronic version, http://goldbook.iupac.org/I02957.html.
- ↑ IUPAC Compendium of Chemical Terminology, Electronic version, http://goldbook.iupac.org/S05498.html.
Bibliografía
editar- K. Peter C. Vollhardt (1994). Química Orgánica. Barcelona: Ediciones Omega S.A. ISBN 84-282-0882-4.