Difluoruro de oxígeno
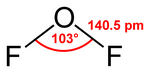
El difluoruro de oxígeno es un compuesto químico con la fórmula OF2. Según la teoría TREPEV, su estructura es similar a la del agua, sin embargo tiene propiedades muy diferentes a esta. Al tener flúor y oxígeno, los elementos más electronegativos que existen, este compuesto es un fuerte oxidante.
  | ||
| Nombre IUPAC | ||
| Difluoruro de oxígeno | ||
| General | ||
| Fórmula semidesarrollada | FOF | |
| Fórmula molecular | OF2 | |
| Identificadores | ||
| Número CAS | 7783-41-7[1] | |
| ChEBI | 30494 | |
| ChemSpider | 22953 | |
| PubChem | 24547 | |
| UNII | 7BCS2CW398 | |
| Propiedades físicas | ||
| Apariencia | Gas incoloro, condensado es un líquido de color pálido amarillo. | |
| Densidad | 1900 kg/m³; 1,9 g/cm³ | |
| Masa molar | 53,9962 g/mol | |
| Punto de fusión | 49,35 K (−224 °C) | |
| Punto de ebullición | 128,35 K (−145 °C) | |
| Índice de refracción (nD) |
+ KPS = | |
| Termoquímica | ||
| ΔfH0gas | 24.5 kJ mol−1 kJ/mol | |
| Peligrosidad | ||
| SGA |
    | |
| NFPA 704 |
0
4
3
OX
| |
| Riesgos | ||
| Inhalación | Tóxico (vapores de flúor), puede causar dolores de cabeza | |
| Piel | Congelamiento (en caso de estar líquido) | |
| Ojos | Quemaduras graves | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Preparación
editarEl difluoruro de oxígeno se registró por primera vez en 1929, fue obtenido por electrólisis del fluoruro de potasio y ácido fluorhídrico fundido, que contiene pequeñas cantidades de agua. La preparación moderna implica la reacción del diflúor con una solución acuosa diluida de hidróxido de sodio, con fluoruro de sodio como un subproducto:
- 2 F2 + 2 NaOH → OF2 + 2 NaF + H2O
Reacciones
editarLas poderosas propiedades oxidantes del difluoruro de oxígeno son demostradas por el número de oxidación de +2 que adquiere el átomo de oxígeno, lo cual es muy inusual, pues el oxígeno tiende a tener número de oxidación -2 en los compuestos covalentes, sin embargo en este caso, por la gran electronegatividad del flúor, adquiere un potencial de reducción mucho mayor, haciendo que se convierta en un oxidante mucho más fuerte. Por encima de 200 °C, OF2 se descompone en dioxígeno y diflúor, a través de un mecanismo de radicales.
El OF2 reacciona con muchos metales para dar origen a óxidos y fluoruros. Algunos no-metales también reaccionan con este compuesto. El fósforo reacciona con este compuesto para formar PF5 y POF3, y con azufre para forma SO2 y SF4, e incluso reacciona con xenón, un gas noble, produciendo XeF4 y otros oxifluoruros de xenón.
El OF2 reacciona muy lentamente con agua para formar ácido fluorhídrico:
- OF2 (aq) + H2O (aq) → 2 HF (aq) + O2 (g)
Este compuesto también es capaz de oxidar el dióxido a azufre a trióxido de azufre:
- OF2 + SO2 → SO3 + F2
No obstante en presencia de luz ultravioleta, se produce fluoruro de sulfurilo (SO2F2) y S2O5F2:
- OF2 + 2 SO2 → S2O5F2
Precaución
editarAl igual que los demás oxidantes, se trata de un compuesto muy peligroso.
