Oxidación de Jones
La oxidación de Jones es una reacción orgánica para la oxidación de alcoholes primarios y secundarios a ácidos carboxílicos y cetonas, respectivamente. Lleva el nombre de su descubridor, Sir Ewart Jones. La reacción fue uno de los primeros métodos para la oxidación de alcoholes. Su uso ha disminuido porque se han desarrollado reactivos más suaves y selectivos, por ejemplo el reactivo de Collins.[1]
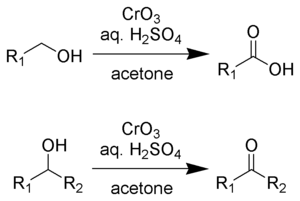
El reactivo de Jones es una solución que se prepara disolviendo trióxido de cromo en ácido sulfúrico acuoso. Para efectuar una oxidación de Jones, esta mezcla ácida se añade luego a una solución de acetona del sustrato. Alternativamente, se puede utilizar dicromato de potasio en lugar de trióxido de cromo. La oxidación es muy rápida y bastante exotérmica. Los rendimientos suelen ser altos. El reactivo es conveniente y económico. Sin embargo, los compuestos de Cr(VI) son cancerígenos, lo que disuade el uso de esta metodología.
Estequiometría y mecanismo.
editarEl reactivo de Jones convertirá alcoholes primarios y secundarios en aldehídos y cetonas, respectivamente. Dependiendo de las condiciones de reacción, los aldehídos pueden convertirse entonces en ácidos carboxílicos. Para las oxidaciones a aldehídos y cetonas, dos equivalentes de ácido crómico oxidan tres equivalentes de alcohol:
- 2 HCrO4− + 3 RR'C(OH)H + 8 H+ + 4 H2O → 2 [Cr(H2O)6]3+ + 3 RR'CO
Para la oxidación de alcoholes primarios a ácidos carboxílicos, 4 equivalentes de ácido crómico oxidan 3 equivalentes del alcohol. El aldehído es un intermediario.
- 4 HCrO4− + 3 RCH2OH + 16 H+ + 11 H2O → 4 [Cr(H2O)6]3+ + 3 RCOOH
Los productos inorgánicos son verdes, característicos de los acuocomplejos de cromo (III).[2]
Como muchas otras oxidaciones de alcoholes por óxidos metálicos, la reacción se produce mediante la formación de un éster de cromato mixto:[3][4] Estos ésteres tienen la fórmula CrO3(OCH2R)-
- CrO3(OH)− + RCH2OH → CrO3(OCH2R)− + H2O
Al igual que los ésteres convencionales, la formación de este éster cromato se acelera mediante el ácido. Estos ésteres se pueden aislar cuando el alcohol es terciario porque carecen del hidrógeno α que se perdería para formar el carbonilo. Por ejemplo, utilizando terbutanol, se puede aislar el cromato de terc -butilo ((CH3)3CO)2CrO2), que es en sí mismo un buen oxidante.[5]
Para aquellas estructuras con hidrógeno alfa respecto al oxígeno, los ésteres de cromato se degradan, liberando el producto carbonilo y un producto Cr(IV) mal definido:
- CrO3(OCH2R)− → CrO2OH− + O=CHR
Los alcoholes deuterados HOCD2R se oxidan aproximadamente seis veces más lentamente que los derivados no deuterados. Este gran efecto isotópico cinético muestra que el enlace C–H (o C–D) se rompe en el paso limitante de la velocidad.
La estequiometría de la reacción implica la especie de Cr(IV) "CrO2OH−", que se conmuta con el ácido crómico para dar un óxido de Cr(V), que también funciona como oxidante del alcohol.[6]
Se propone que la oxidación de los aldehídos se produzca mediante la formación de intermedios similares a hemiacetales, que surgen de la adición del enlace O3CrO-H− a través del enlace C=O.
El reactivo rara vez oxida enlaces insaturados.
Reacciones y aplicaciones ilustrativas.
editarSigue siendo útil en síntesis orgánica.[2][7] Se puede utilizar una variedad de técnicas espectroscópicas, incluida la espectroscopía infrarroja, para monitorear el progreso de una reacción de oxidación de Jones. Hubo un tiempo en que la oxidación de Jones se usaba en alcoholímetros.
Procesos relacionados
editarLos reactivos principales son el reactivo de Collins, PDC y PCC. Estos reactivos representan mejoras con respecto a los reactivos de cromo (VI) inorgánicos, como el reactivo de Jones.
Referencias históricas
editar- Bowden, K.; Heilbron, I. M.; Jones, E. R. H (1946). «13. Researches on acetylenic compounds. Part I. The preparation of acetylenic ketones by oxidation of acetylenic carbinols and glycols». J. Chem. Soc.: 39. doi:10.1039/jr9460000039.
- Heilbron, I.M.; Jones, E.R.H.; Sondheimer, F (1949). «129. Researches on acetylenic compounds. Part XV. The oxidation of primary acetylenic carbinols and glycols». J. Chem. Soc.: 604. doi:10.1039/jr9490000604.
- Bladon, P; Fabian, Joyce M.; Henbest, H. B.; Koch, H. P.; Wood, Geoffrey W. (1951). «532. Studies in the sterol group. Part LII. Infra-red absorption of nuclear tri- and tetra-substituted ethylenic centres». J. Chem. Soc.: 2402. doi:10.1039/jr9510002402.
- Jones, E. R. H (1953). «92. The chemistry of the triterpenes. Part XIII. The further characterisation of polyporenic acid A». J. Chem. Soc.: 457. doi:10.1039/jr9530000457.
- Jones, E. R. H (1953). «520. The chemistry of the triterpenes and related compounds. Part XVIII. Elucidation of the structure of polyporenic acid C». J. Chem. Soc.: 2548. doi:10.1039/jr9530002548.
- Jones, E. R. H (1953). «599. The chemistry of the triterpenes and related compounds. Part XIX. Further evidence concerning the structure of polyporenic acid A». J. Chem. Soc.: 3019. doi:10.1039/jr9530003019.
- C. Djerassi, R. Engle and A. Bowers (1956). «Notes – The Direct Conversion of Steroidal Δ5-3β-Alcohols to Δ5- and Δ4-3-Ketones». J. Org. Chem. 21 (12): 1547-1549. doi:10.1021/jo01118a627.
Referencias
editar- ↑ «Chromium-based Reagents». Oxidation of Alcohols to Aldehydes and Ketones. Basic Reactions in Organic Synthesis. 2006. pp. 1-95. ISBN 0-387-23607-4. doi:10.1007/0-387-25725-X_1.
- ↑ a b Eisenbraun, E. J. (1965). "Cyclooctanone". Organic Syntheses. 45: 28.
- ↑ Fillmore Freeman, "Di-tert-butyl Chromate" Encyclopedia of Reagents for Organic Synthesis, 2001, John Wiley & Sons, Ltd.
- ↑ Ley, S. V.; Madin, A. (1991). B. M. Trost; I. Fleming, eds. Comprehensive organic synthesis 7. Oxford: Pergamon Press. pp. 253-256.
- ↑ Fillmore Freeman, "Di-tert-butyl Chromate" Encyclopedia of Reagents for Organic Synthesis, 2001, John Wiley & Sons, Ltd. doi 10.1002/047084289X.rd059m
- ↑ Oxidation in Organic Chemistry. Edited by K. B. Wiberg, Academic Press, NY, 1965.
- ↑ "Nortricyclanone". Org. Synth..