Reacción de sustitución
Una reacción de sustitución (también denominada reacción de desplazamiento único o reacción de substitución unitaria) a es aquella reacción química en la que un grupo funcional o átomo en un compuesto químico es sustituido por otro átomo o grupo funcional.[1][2]
Son procesos químicos donde las sustancias intervinientes, sufren cambios en su estructura, para dar origen a otras sustancias. El cambio es más fácil entre sustancias líquidas o gaseosas, o en disolución, debido a que se hallan más separadas y permiten un contacto más íntimo entre los cuerpos reaccionantes.
Las reacciones de sustitución son de suma importancia en la química orgánica. Las reacciones de sustitución en química orgánica se clasifican como electrófilas o nucleófilas dependiendo del reactivo involucrado, si un reactivo intermediario involucrado en la reacción es un carbocatión, un carbanión o un radical libre, y si el sustrato es alifático o aromático. La comprensión detallada de un tipo de reacción ayuda a predecir el resultado del producto en una reacción. También es útil para optimizar una reacción con respecto a variables como la temperatura y la elección del disolvente.
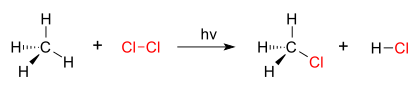
Un buen ejemplo de una reacción de sustitución es halogenación. Cuando se irradia cloro gas (Cl2), algunas de las moléculas se dividen en dos radicales de cloro (Cl•), cuyos electrones libres son fuertemente nucleofílico. Uno de ellos rompe un enlace covalente C-H en CH4 y toma el átomo de hidrógeno para formar el HCl eléctricamente neutro. El otro radical reforma un enlace covalente con el CH3• para formar CH3Cl (cloruro de metilo).
| Cloración de metano por cloro |
|---|
Química orgánica
editarEn química orgánica las sustituciones nucleófilas o electrófilas son muy importantes. Las reacciones de sustitución se clasifican en diferentes tipos según si el reactivo que lleva a cabo la sustitución es un nucléofilo, un electrófilo o un radical libre o si el sustrato es alifático o aromático. El entendimiento detallado de las diferentes reacciones de sustitución ayuda a predecir el producto resultante. Esto además permite optimizar una reacción respecto a variables como la temperatura o la elección del disolvente.
Halogenación radicalaria
editar- En alcanos:
- RH + X2 → RX + HX
Sustitución nucleófila
editar- Nu- + CH3X → NuCH3 + X-
- (CH3)3CX → (CH3)3C+ + X- (Reacción de equilibrio)
- (CH3)3C+ + Nu- → (CH3)3CNu
- Adición-eliminación en derivados de ácidos carboxílicos (sustitución nucleófila acílica):
Sustitución electrófila aromática
editarQuímica de coordinación
editarEn química de coordinación en los complejos de los metales de transición en disolución también se producen reacciones de sustitución de un ligando por otro:
- M-X + Y → M-Y + X
Donde X es el grupo saliente e Y el grupo entrante. Si el grupo entrante desplaza una molécula de agua se conoce como anación o anionización, y si es al revés donde una molécula de agua desplaza a un ligando es una hidrólisis o acuatización.
Según su mecanismo las reacciones de sustitución de ligando pueden ser de tipo:
- Disociativo (D), donde se evidencia la existencia de un intermedio con un número de coordinación inferior al complejo inicial. Tiene lugar una previa disociadión del grupo saliente X seguida de una coordinación con el grupo entrante. En este caso la etapa determinante de la velocidad es la disociación de X.
- [MLnX] → [MLn] + X (Reacción de equilibrio)
- [MLn] + Y → [MLnY]
- Asociativo (A), donde se comprueba que existe un intermedio con un número de coordinación superior al complejo inicial. En este caso, primero tiene lugar la coordinación del grupo entrante Y y finalmente la disociación del grupo saliente.La etapa limitante de la velocidad de reacción es la formación del enlace con el grupo entrante Y.
- [MLnX] + Y → [MLnXY] → [MLnY] + X
- Intercambio (I), donde no existe evidencia de intermedio. Se trata de un proceso concertado. Se diferencia entre intercambio asociativo (Ia) si la asociación va algo por delante de la formación de nuevos enlaces o disociativo (Id) si es a la inversa.
Por tanto los dos primeros son mecanismos que tienen lugar en dos etapas y el segundo en una sola.
Química inorgánica y organometálica
editarAunque es habitual hablar de reacciones de sustitución en el contexto de la química orgánica, la reacción es genérica y se aplica a una amplia gama de compuestos. Los ligandos de los complejos de coordinación son susceptibles de sustitución. Se han observado mecanismos tanto asociativos como disociativos.[3][4]
La sustitución asociativa, por ejemplo, se aplica típicamente a la organometálicos y complejos de coordinación, pero se asemeja a la mecanismo SN2 en química orgánica. La vía opuesta es la sustitución disociativa, siendo análoga a la vía SN1.
Ejemplos de mecanismos asociativos se encuentran comúnmente en la química de los complejos metálicos de 16e cuadrangular, por ejemplo el complejo de Vaska y el tetracloroplatinato. La ecuación cinética se rige por el Mecanismo de Eigen-Wilkins.
La substitución disociativa se asemeja a al mecanismo SN1 en la química orgánica. This pathway can be well described by the efecto cis , o la labilization of CO ligands in the cis position. Los complejos que se someten a sustitución disociativa son a menudo saturación coordinada y, a menudo, tienen geometría molecular octaédrica. La entropía de activación es característicamente positiva para estas reacciones, lo que indica que el desorden del sistema reaccionante aumenta en el paso determinante de la velocidad. Las vías disociativas se caracterizan por un paso determinante de la velocidad que implica la liberación de un ligando de la esfera de coordinación del metal que sufre la sustitución. La concentración del nucleófilo sustituyente no tiene influencia en esta tasa, y se puede detectar un intermedio de número de coordinación reducido. La reacción se puede describir con k1, k−1 y k2, que son las constantes cinéticas de sus correspondientes pasos de reacción intermedios:
Normalmente, el paso determinante de la velocidad es la disociación de L del complejo, y [L'] no afecta a la velocidad de reacción, lo que conduce a la ecuación de velocidad simple:
Historia de la reacción de sustitución
editarA principios del siglo XIX se formularon diversas hipótesis y teorías sobre la estructura y formación de cuerpos orgánicos[5]
Panorama general
editarA principios y mediados del siglo XIX, había esencialmente dos teorías que competían para explicar el compuesto químico en química orgánica, ellas eran la teoría dualista-adicional en torno a Jöns Jakob Berzelius y la teoría conocida como teoría radical o teoría nuclear (química). teoría del núcleo de Justus von Liebig, Friedrich Wöhler y Auguste Laurent por un lado, y la conceptualización de Jean Baptiste Dumas y el descubrimiento de la sustitución como teoría de tipo unitarista por otro.[6]
Teoría dualista-adicional
editarJöns Jakob Berzelius utilizó por primera vez el término química orgánica en 1808 y publicó el primer tratado independiente sobre compuestos orgánicos en 1827. Fueron importantes para él la consideración de las proporciones químicas en los compuestos y el desarrollo de la estequiometría. Berzelius se propuso la tarea de determinar las proporciones según las cuales cuerpos orgánicos se combinan con la mayor precisión posible. En las sales, por ejemplo, estableció que la cantidad de oxígeno en el ácido y en la base están en una relación entera simple entre sí, como Joseph-Louis Proust ya había formulado en 1807 en su Ley de las proporciones constantes. Para Berzelius, los resultados de sus análisis estequiométricos fueron también una confirmación de la hipótesis atómica de John Dalton de 1803. Acuñó los términos electronegativo y electropositivo y estableció una escala de electronegatividad. Berzelius explicó la afinidad de los cuerpos químicos por la intensidad de su polaridad; en el unión de dos elementos, los átomos se contraponen con sus polos opuestos. En cambio, con una corriente eléctrica se podía restablecer la polaridad original de un compuesto o desensamblar sus átomos.
Su hipótesis explicaba importantes cuestiones de la química de su época. La base de este sistema era la suposición de que todo cuerpo químico se compone de dos partes, una electropositiva y otra electronegativa. Berzelius construyó en torno a Humphry Davy la teoría dualista-adicional apoyada en experimentos electroquímicos, según la cual todo compuesto químico debía entenderse como la unión de un ácido electronegativo y una base electropositiva.[7]
Teoría radical
editarLa investigación de muchos compuestos reveló que muy a menudo están formados sólo por tres o cuatro elementos, a saber, carbono, hidrógeno, oxígeno y, raramente, nitrógeno. Se podía determinar la fórmula molecular de los cuerpos químicos, pero se conocían muchas sustancias que tenían propiedades completamente distintas con la misma composición (fórmula molecular), es decir, eran sustancias diferentes. Por tanto, las propiedades químicas también dependían de la combinación de los elementos entre sí, pero la estructura de un compuesto aún no podía determinarse con los métodos anteriores.
También se suponía que en una reacción química, todas las sustancias implicadas se descompondrían en sus componentes y se recombinarían. Por ello, Liebig y Wöhler desarrollaron un modelo en el que suponían que una sustancia estaba formada por varios grupos de elementos más pequeños, los llamados radicales, que se mantendrían inalterados durante una reacción.
El término radical en el sentido de la teoría radical es not' comparable al término moderno radical (como se utiliza más arriba en 1.4 Sustitución radical) en los conceptos actuales de la química teórica. En la teoría radical se hacen afirmaciones sobre la composición de un cuerpo químico, que consta de varios grupos pequeños de elementos, es decir, los radicales. La teoría radical se basaba en el supuesto de que los radicales, es decir, los pequeños grupos de elementos, son invariables.
Sin embargo, esto contradecía el hecho de que la fórmula sumatoria de las sustancias a menudo sólo cambiaba ligeramente durante una reacción y, por lo tanto, no se podían aplicar los descubrimientos de la química inorgánica ya desarrollada.[8]
Teoría unitaria
editarSegún Berzelius, el carbono era la partícula electronegativa y el hidrógeno la partícula electropositiva en un compuesto orgánico. Según su idea, era imposible que una partícula electropositiva como el hidrógeno fuera desplazada por una partícula electronegativa como el cloro. Basándose en sus puntos de vista dualistas, Berzelius opinaba que en un compuesto como el cloruro de metileno, uno de los átomos de hidrógeno electropositivo no podía ser sustituido por otro, el tercer cloro electronegativo, para formar cloroformo.
Teoría del tipo y del núcleo
editarEn 1834, Jean-Baptiste Dumas fundó la teoría de la sustitución (sustituibilidad del hidrógeno de los compuestos orgánicos por, por ejemplo, halógenos) y en 1839, en París, estableció una teoría tipo' del enlace químico. Se cuenta la siguiente anécdota: En el primer tercio del siglo XIX, el rey Carlos X de Francia (1757-1836) ofreció una recepción nocturna, soirée de gala. Se encendieron muchas velas blancas en el palacio: pero la cera de estas velas se quemaba, produciendo mucho hollín. También provocó una grave irritación de las vías respiratorias, y algunos de los invitados a la gala sufrieron ataques de tos extrema. El rey encargó al experto de la corte en cuestiones químicas, el director de la Real Fábrica de Porcelana Alexandre Brongniart, que esclareciera las causas de este incidente. Brongniart, por su parte, encargó la investigación a su yerno, Jean-Baptiste Dumas. Éste llegó a la siguiente conclusión: los vapores asfixiantes eran cloruro de hidrógeno gaseoso (HCl) que se desarrollaban durante la combustión de la cera de las velas y provocaban irritación de las mucosas y las vías respiratorias al ser inhalados. También pudo demostrar que el fabricante de cera había blanqueado la materia prima con cloro. El cloro estaba parcialmente unido químicamente a la cera, liberando cloruro de hidrógeno cuando se quemaba.[9] Además de los beneficios prácticos para la producción posterior de velas, el análisis del incidente condujo a una nueva comprensión teórica dentro de la química orgánica. Sin embargo, Jean-Baptiste Dumas demostró la sustitución del hidrógeno por cloro cuando se aplicaba cloro a la cera de las velas, contradiciendo así la opinión de Berzelius de que el hidrógeno electropositivo no podía ser sustituido por el cloro electronegativo.[10]
Una teoría de tipos modificada fue desarrollada por Charles Frédéric Gerhardt. Según sus ideas, todos los compuestos orgánicos podían clasificarse en cuatro tipos: Hidrógeno, cloruro de hidrógeno, agua y amoníaco. El concepto de valencia química se derivó de la teoría de los tipos. La teoría de las series homólogas, que ya había sido insinuada por sus predecesores, tomó forma firme en su obra (1845); también originó el concepto de heterología. La conclusión más importante de la teoría de los tipos y de las homólogas fue que exigen un sistema unitario, en contraste con el dualista de Berzelius.
En 1836, Auguste Laurent formuló la teoría nuclear, según la cual existen los llamados núcleos parentales (o, lo que es lo mismo, radicales, en sentido amplio), como el carbono y el hidrógeno, y los núcleos derivados, que surgen de los núcleos parentales al reemplazar (sustituir) el hidrógeno por otros átomos o grupos. En las moléculas orgánicas, a diferencia de la química inorgánica, existen núcleos parentales de átomos de carbono. Los núcleos parentales de carbono están organizados espacialmente y pueden alojar núcleos secundarios de átomos de hidrógeno, cloro u oxígeno según leyes geométricas y estequiométricas. Sólo algunos núcleos secundarios específicos de la molécula pueden separarse y formar un radical.
Laurent sospechaba que los núcleos parentales podían estar situados en el centro de una pirámide, con núcleos secundarios como átomos de hidrógeno, oxígeno y halógeno situados en los bordes de la pirámide, que pueden intercambiarse en determinadas condiciones de reacción.[11] Se trata de la teoría nuclear (química).
Referencias
editar- ↑ March, Jerry (1985), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (3rd ed.), New York: Wiley, ISBN 0-471-85472-7
- ↑ Imyanitov, Naum S. (1993). «Is This Reaction a Substitution, Oxidation-Reduction, or Transfer?». J. Chem. Educ. 70 (1): 14-16. Bibcode:1993JChEd..70...14I. doi:10.1021/ed070p14.
- ↑ Basolo, F.; Pearson, R. G. "Mechanisms of Inorganic Reactions". John Wiley and Son: Nueva York: 1967. ISBN 0-471-05545-X
- ↑ {Wilkins, R. G. (1991). Cinética y mecanismo de reacciones de complejos de metales de transición (2ª edición). Weinheim: VCH. ISBN 1-56081-125-0. (requiere registro).
- ↑ William. H. Brock: The Norton History of Chemistry. Norton, Nueva York 1992, pp. 210-269.
- ↑ Wilhelm Strube: Geschichte der Chemie.' Volumen 2, Klett, Düsseldorf 2007, pp. 27-34.
- ↑ Wilhelm Strube: Jöns Jacob Berzelius. (PDF; 15 kB). Didáctica de la Química Universidad de Oldenburg.
- ↑ Horst Remane: Friedrich Wöhler.] (PDF; 221 kB). Didáctica de la Química Universidad de Oldenburg.
- ↑ Hjelt Edvard: Geschichte der Organischen Chemie von ältester Zeit bis zur Gegenwart.]. (PDF; 4,4 MB). Vieweg & Sohn, Brunswick 1916.
- ↑ Horst Remane: Jean-Baptiste André Dumas.]. (PDF; 253 kB). Didáctica de la Química Universidad de Oldenburg.
- ↑ August Kekulé et al: Lehrbuch der organischen Chemie. Volumen 1, p. 66 y ss. (Google Books).
Bibliografía
editar- K. Peter C. Vollhardt (1994). Química Orgánica. Barcelona: Ediciones Omega S.A. ISBN 84-282-0882-4.
- A.G. Sharpe (1993). Química Inorgánica. Barcelona: Editorial Reverté, S.A. ISBN 84-291-7501-6.
- D.F. Shriver, P.W. Atkins, C.H. Langford (1998). Química Inorgánica. Barcelona: Editorial Reverté, S.A. ISBN 84-291-7006-5.