Terc-butil-litio
El terc-butil-litio es un compuesto organometálico de fórmula química (CH3)3CLi, abreviado terc-BuLi o t-BuLi. Este reactivo de organolitio se utiliza como fuente del carbanión terc-butilo en síntesis orgánica, además de como una base fuerte, capaz de desprotonar muchas moléculas orgánicas, incluido el benceno. El terc-butil-litio está disponible comercialmente como disoluciones de hidrocarburos; no se suele preparar en el laboratorio. Su síntesis fue reportada por primera vez por R. B. Woodward en 1941.[2]
| terc-Butil litio | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| (2-Metil-2-propanil)litio | ||
| General | ||
| Símbolo químico | terc-BuLi | |
| Fórmula estructural |
 | |
| Fórmula molecular | C4H9Li | |
| Identificadores | ||
| Número CAS | 594-19-4[1] | |
| ChemSpider | 10254347 | |
| PubChem | 638178 | |
| Propiedades físicas | ||
| Masa molar | 6406 g/mol | |
| Propiedades químicas | ||
| Acidez | 45-53 pKa | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Síntesis
editarLa síntesis se puede realizar haciendo reaccionar bromuro de terc-butilo con litio (polvo).
El enlace carbono-litio es muy polar, lo que hace que el carbono sea básico, como en otros reactivos de organolitio.
Propiedades químicas
editarLa basicidad aumenta en la serie n-butil-litio < sec-butil-litio < terc-butil-litio. El t-BuLi es, por lo tanto, la base más fuerte de esta serie. Puede formarse un precipitado fino de hidruro de litio e isobuteno durante el almacenamiento, lo cual conduce a una reducción en la concentración de las disoluciones a lo largo del tiempo. El isobuteno resultante es desprotonado por más t-BuLi en la posición alilo, lo que conduce a una mayor reducción en la concentración de t-BuLi.
Estructura química y enlace
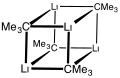
editarAl igual que otros compuestos de organolitio, el terc-butil-litio es un clúster. Mientras que el n-butil-litio existe como hexámero y tetrámero, el terc-butil-litio existe como tetrámero con estructura de cubano. La unión en grupos de organolitio implica la deslocalización del enlace sigma y una unión Li-Li significativa.[3]
El enlace litio-carbono en el tert-butillitio está altamente polarizado y tiene un carácter iónico de alrededor del 40 por ciento. La molécula reacciona como un carbanión, como lo representan estas dos estructuras de resonancia.[4] (Dados los cálculos de polaridad en el enlace C-Li, la estructura "real" de una sola molécula de t-butil-litio es probablemente un promedio cercano de los dos contribuyentes de resonancia que se muestran, en los que el átomo de carbono central tiene un ~ 50% parcial carga negativa mientras que el átomo de litio tiene una carga positiva parcial ~50%).
Propiedades químicas
editarAl igual que el n-butil-litio, el terc-butil-litio se puede utilizar para el intercambio de litio con halógenos y para la desprotonación de aminas y compuestos C−H activados.
Se sabe que este compuesto y otros compuestos de alquil-litio reaccionan con disolventes de éter; la vida media del terc-butil-litio es de 60 minutos a 0 °C en éter etílico, 40 minutos a -20 °C en tetrahidrofurano (THF)[5] y aproximadamente 11 minutos a -70 °C en dimetoxietano.[6] En este ejemplo, se muestra la reacción de terc-butillitio con (THF):
Aplicaciones
editarEl t-BuLi ha ganado importancia en la química orgánica sintética moderna como base ultrafuerte o como reactivo litiante. Debido a que es mucho más pirofórico que el n-BuLi , se usa con menos frecuencia. En algunos casos se usa debido a la mayor basicidad o por razones estéricas (el grupo t-butilo es espacialmente grande y voluminoso).
Seguridad
editarEl t-BuLi también es extremadamente pirofórico en disolución (se enciende espontáneamente en el aire a 54,55 °C o menos[7]). Por lo tanto, la manipulación y el almacenamiento deben realizarse siempre bajo gas protector. El t-BuLi también reacciona violentamente con agua para formar hidróxido de litio e isobuteno. Si se almacena durante un período de tiempo más prolongado, se forma un depósito de hidruro de litio pirofórico (de autodescomposición) e hidróxido de litio (por la humedad que ha penetrado).
Se han producido accidentes de laboratorio graves relacionados con el terc-butil-litio. Por ejemplo, en 2008, en la Universidad de California, en Los Ángeles, murió un investigador después de sufrir quemaduras graves por un incendio provocado por terc-butil-litio .[8][9][10]
Referencias
editar- ↑ Número CAS
- ↑ Bartlett, Paul D.; C. Gardner Swain; Robert B. Woodward (1941). «t-Butyllithium». J. Am. Chem. Soc. 63 (11): 3229-3230. doi:10.1021/ja01856a501.
- ↑ Elschenbroich, C. "Organometallics" (2006) Wiley-VCH: Weinheim. ISBN 978-3-527-29390-2
- ↑ Organometallic reagents: sources of nucleophilic carbon for alcohol synthesis. K. P. C. Vollhardt, N. E. Schore: Organic Chemistry : Structure And Function. 3rd edition, 1999, §8.7.
- ↑ Stanetty, P; Koller, H.; Mihovilovic, M. (1992). «Directed ortho lithiation of phenylcarbamic acid 1,1-dimethylethyl ester (N-BOC-aniline). Revision and improvements». Journal of Organic Chemistry 57 (25): 6833-6837. doi:10.1021/jo00051a030.
- ↑ Fitt, J. J.; Gschwend, H. E. (1984). «Reaction of n-, sec-, and tert-butyllithium with dimethoxyethane (DME): a correction». Journal of Organic Chemistry 49: 209-210. doi:10.1021/jo00175a056.
- ↑ SEMI, standard F6-92, Guide for Secondary Containment of Hazardous Gas Piping Systems, as cited by ChemiCool.com
- ↑ Jyllian Kemsley (22 de enero de 2009). «Researcher Dies After Lab Fire». Chemical & Engineering News.
- ↑ Jyllian Kemsley (3 de abril de 2009). «Learning From UCLA: Details of the experiment that led to a researcher's death prompt evaluations of academic safety practices». Chemical & Engineering News.
- ↑ Los Angeles Times, 2009-03-01