Inhibidor de la enzima convertidora de angiotensina
Los inhibidores de la enzima convertidora de angiotensina ('IECA:) son una clase de medicamentos que se emplean principalmente en el tratamiento de la hipertensión arterial, de la insuficiencia cardíaca crónica y también de la enfermedad renal crónica y forman parte de la inhibición de una serie de reacciones que regulan la presión sanguínea: el sistema renina-angiotensina-aldosterona. Las sustancias inhibidoras ECA se descubrieron por primera vez en venenos de serpientes. Los inhibidores ECA más importantes utilizados para tratamientos son el captopril (Capoten), el enalapril, el lisinopril y el ramipril. Por su gran significado terapéutico, se cuentan entre los fármacos más vendidos.
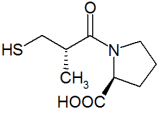
Historia
editarEn 1956 se sentaron las bases para el desarrollo de los inhibidores ECA cuando Leonard T. Skeggs consiguió explicar el funcionamiento de y aislar la enzima de conversión de la angiotensina (ECA), sin subestimar la importancia de esta enzima para la regulación de la presión sanguínea.[1][2]
Unos 14 años después del descubrimiento de la enzima de conversión de la angiotensina (1970), el farmacólogo Sergio H. Ferreira descubrió que el veneno de la jararaca o víbora lanceolada (Bothropoides jararaca), in vitro, es capaz de inhibir a esta enzima. Asimismo, con el pentapéptido BPP5a contenido en este veneno de serpiente se aisló uno de los componentes efectivos de esta acción inhibitoria.[3]
Puesto que el BPP5a es muy inestable en el organismo, casi simultáneamente se inició la búsqueda de inhibidores más potentes y estables de la enzima. En 1971 se consiguió un primer éxito con el descubrimiento del efecto inhibidor de ECA del nonapéptido teprotido el cual tiene efectos hipotensores muy similares al del veneno de la jararaca.[4] No obstante, dos años más tarde se abandonó el posterior desarrollo clínico del teprotido por falta de interés comercial por parte del fabricante.
Igualmente, a principios de los años 1970 se descubrió la estructura parcial efectiva del péptido BPP5a y del teprotido, ambos inhibidores de la ECA. A partir de estos descubrimientos se desarrollaron nuevos inhibidores ECA no péptidos. En 1974 se describió por primera vez el inhibidor ECA captopril, que era el producto de la búsqueda a gran escala de un fármaco (tamizado) a cargo de la empresa farmacéutica Squibb.[5] En 1981 esta fue la primera sustancia que se empleó como inhibidor ECA en un tratamiento. Dos años más tarde siguió la comercialización de un segundo inhibidor ECA con el enalapril.
Con el fin de minimizar los efectos adversos y aprovechar el éxito terapéutico y económico de los fármacos captopril y enalapril se desarrolló una segunda generación de inhibidores ECA, de adquisición en el mercado desde principios de los años 1990, tales como el lisinopril y ramipril.
Composición química
editarLos inhibidores ECA como el captopril, el enalapril y sus sustancias derivadas tienen una estructura similar a la del péptido BPP5a o péptido potenciador de la bradiquinina, (BPP, de las siglas en inglés "bradykinin-potentiating peptide); aislado del veneno de la serpiente jararaca o víbora lanceolada brasileña (Bothrops jararaca). Se ha descubierto que la secuencia tripéptida de triptófano-alanina-prolina formada por tres aminoácidos y que aparece en el BPP5a es uno de los componentes activos en las propiedades de estas moléculas.[cita requerida]
Puesto que el cuerpo elimina con mucha rapidez el BPP5a y el tripéptido, se han llevado a cabo numerosas modificaciones en la molécula para prolongar la duración del efecto, entre ellas, se ha cambiado la secuencia del triptófano-alanina-prolina por una secuencia similar pero más estable de fenilalanina-alanina-prolina. La aportación de una estructura análoga al ácido succínico o al ácido glutárico proporcionó más estabilidad y reforzó las propiedades inhibidoras en la enzima de conversión de la angiotensina.[cita requerida]
Además, todos los inhibidores ECA empleados salvo el captopril y el lisinopril son profármacos que se activan una vez dentro del organismo. En el caso del enalapril esto se produce por separación del grupo etílico mediante las esterasas, gracias a lo cual se obtiene la forma efectiva, el enalaprilato, con un grupo carboxílico libre.[cita requerida]
Indicaciones clínicas
editarLos inhibidores ECA se emplean principalmente para el tratamiento de la hipertensión, para la que se consideran en muchos casos, tanto solos (tratamiento único o monoterapia) como en combinación con otros hipotensores (tratamiento combinado, especialmente con diuréticos o bloqueadores de canales de calcio), el remedio preferente.[6] Por ello se encuentra en el mercado una combinación de productos que combinan un IECA con un diurético tiazida, como es el caso de la hidroclorotiazida en una tableta para la administración directa a pacientes que así lo requieran. Por el contrario, en ciertas formas de hipertensión acompañadas de un nivel reducido de renina en el plasma sanguíneo (por ejemplo, la enfermedad de Crohn), los inhibidores ECA muestran una efectividad insuficiente.
Además, numerosos ensayos clínicos han demostrado que los inhibidores de la enzima convertidora de angiotensina han permitido reducir la morbilidad y prolongar la vida de pacientes con insuficiencia cardíaca crónica.[7] Esto se debe probablemente a la disminución de la poscarga y la reducción de la tensión de la pared del miocardio mediante la reducción de la angiotensina II.
Incluso tras infartos de miocardio se emplean los inhibidores ECA los cuales han reducido la morbilidad y mortalidad en los pacientes así tratados. Se ha demostrado que el enalapril mejora considerablemente la calidad de vida en pacientes con disfunción ventricular izquierda disminuyendo la velocidad de aparición de agrandamiento ventricular. [8]
Otra indicación de los inhibidores ECA es la nefropatía diabética, tanto en la prevención de la enfermedad como en sus estados iniciales. Los IECA preservan la función renal independiente del control de la tensión arterial y disminuyen la proteinuria tanto en pacientes diabéticos normotensos como hipertensos.[9] Aunque no siempre se logra impedir el progreso de una nefropatía diabética, los IECA tienden a revertir la fase de microalbuminuria de la enfermedad.[10]
Mecanismo de acción
editarEl mecanismo de acción de los inhibidores IECA consiste en inhibir la enzima que actúa en la conversión de la angiotensina I en angiotensina II,. Esta enzima tiene dos funciones principales en el organismo. Por un lado, se encarga de sintetizar la angiotensina II, un octapéptido (péptido formado por 8 aminoácidos) vasoconstrictor efectivo, a partir de su preestadio inactivo, el decapéptido (10 aminoácidos) angiotensina I, separando dos aminoácidos del extremo C terminal de la molécula. Por el otro, cataliza la eliminación del mediador bradiquinina en productos inactivos.[11]
La vasoconstricción mediada por la angiotensina II es rápida e intensa a nivel de las arteriolas y no tanto a nivel de las venas. La constricción arteriolar aumenta la resistencia vascular periférica con respecto al corazón, aumentando así la presión arterial.[12] La constricción venosa aumenta el retorno venoso. La angiotensina II también aumenta la presión arterial por su efecto renal, disminuyendo la excreción del catión sodio y de agua haciendo que el volumen extracelular aumente.
La inhibición de la enzima que convierte la angiotensina en un vasoconstrictor activo hace que la concentración de angiotensina II a nivel de los receptores de angiotensina (AT1 y AT2) disminuya. Así, se reduce el tono vascular, lo que atenúa la resistencia vascular sistémica y disminuye la presión sanguínea, tanto sistólica como diastólica.[12] A continuación, la reducción del nivel de angiotensina II conlleva a una reducción de la secreción de la hormona aldosterona de la glándula suprarrenal y con ello se determina el contenido de agua sanguíneo. Se piensa que la angiotensina puede ser producida en otros tejidos incluyendo el corazón.[11] A nivel celular, puede observarse un retroceso de los efectos de los mitógenos inducidos por la angiotensina II en los fibroblastos y los miocitos del corazón, que conllevan alteraciones adversas especialmente tras un infarto de miocardio (remodelación).
La bradiquinina es un potente vasodilatador por medio de la liberación del óxido nítrico y la prostaciclina. Algunos de los IECAs son capaces de mantener la acción de la bradiquinina produciendo una disminución de la resistencia vascular periférica y, por ende, la presión arterial.[11]
En caso de enfermedades renales como la nefropatía diabética los inhibidores ECA ocasionan una reducción de la eliminación de las proteínas (proteinuria) y previenen el avance de la enfermedad (nefroprotección).
La inhibición de la eliminación de la bradiquinina supone contrariamente su acumulación y los efectos secundarios relacionados con ella.
Mecanismo de efecto molecular
editarTambién se ha podido explicar el mecanismo de efecto molecular de los inhibidores ECA. Se basa en la similitud de los inhibidores ECA con uno de los extremos de la cadena de péptidos de la angiotensina I. Así, la enzima de conversión de la angiotensina confunde los inhibidores ECA con el Sustrato (bioquímica) fisiológico de la angiotensina I. Sin embargo, a diferencia de lo que ocurre con el Sustrato (bioquímica) fisiológico, la enzima, en vez de transformarlos, queda bloqueada por ellos.[cita requerida]
| Mecanismo de efecto molecular de los inhibidores ECA: Los inhibidores ECA (por ejemplo, enalaprilato) se enlazan en el dominio de unión al ligando de la enzima de conversión de la angiotensina (ECA, en lugar del Sustrato (bioquímica) de angiotensina I), bloqueando esta enzima. |
Farmacología
editarLos inhibidores ECA se distinguen entre sí en la farmacocinética según sus diferencias químicas. La mayoría de inhibidores ECA disponibles en la actualidad son profármacos. Esto implica que tras una absorción de un 20 % (ramipril) a casi un 100 % (resorción) deben activarse por la acción de enzimas presentes en el cuerpo (véase la composición química). Los únicos que no necesitan este paso son el captopril y el lisinopril. Al cabo de 1 a 8 horas se alcanza el nivel máximo de plasma de las formas efectivas. La vida media de eliminación oscila entre 2 (captopril) y 40 horas (espirapril). La duración del efecto varía de la manera correspondiente (8 a 48 horas). Los inhibidores ECA se eliminan principalmente por los riñones. Además, el fosinopril, el moexipril y el espirapril muestran una excreción biliar relevante (eliminación por la bilis).[11]
Efectos secundarios
editarLa mayoría de los efectos secundarios de los inhibidores ECA se relacionan con una eliminación y una acumulación lentas de la bradiquinina. Entre ellas, se encuentran reacciones cutáneas como los exantemas (0,1 - 1 %) y la urticaria en hasta un 10 % de los pacientes. Por el contrario, raras veces se observan reacciones alérgicas cutáneas graves (< 0,01 %). El efecto secundario considerado característico de los inhibidores ECA, la aparición de edemas angioneuróticos, se ha podido observar de forma muy aislada (0,01 -0,1 %).[cita requerida]
La mayoría de efectos secundarios que afectan a las vías respiratorias igualmente se pueden relacionar con la acumulación de bradiquinina. Entre ellas se encuentran la tos seca,[11] la disfonía y el dolor de garganta (0,1 - 1 %). Igualmente, pueden aparecer ataques de asma e insuficiencia respiratoria, si bien también suelen ser inusuales (0,01 - 0,1 %).[cita requerida]
Durante el tratamiento con inhibidores de la ECA el paciente puede sufrir una fuerte hipotensión independientemente de la acción de la bradiquinina. En consecuencia, pueden observarse mareos, dolor de cabeza y sopor (0,1 - 1 %). Solo en casos aislados se han registrado episodios cardiovasculares graves, como anginas de pecho, infarto de miocardio y síncopes. Por razón de su efecto sobre el contenido de agua y electrolitos en el cuerpo, el uso de IECAs puede producir en ciertos pacientes trastornos renales funcionales (0,1 - 1 %). En cambio, muy raras veces se ha observado una proteinuria (eliminación de las proteínas en la orina) (0,01 - 0,1 %).[cita requerida]
Los efectos del sistema-renina-angiotensina-aldosterona con reducción de la secreción de aldosterona son los responsables de otro efecto indeseado de los IECA: la aldosterona potencia, por un lado, la reabsorción de sodio y agua en los riñones y, por el otro, facilita la eliminación de potasio. Una concentración reducida de aldosterona provoca el efecto contrario: una mayor eliminación de sodio y agua por los riñones y una retención superior de potasio en el cuerpo. De esto modo, puede llegar a producirse una hiperpotasemia, peligrosa especialmente para el corazón, frecuente en pacientes diabéticos y con insuficiencia renal.[11][10] Raras veces se produce una hiponatremia. Ello tiene importancia en intervenciones quirúrgicas de pacientes que usan IECAs crónicamente, aumentando el riesgo de trastornos en el balance hídrico durante la operación por la administración de anestesia, el cual a su vez disminuye el volumen hídrico que llega al ventrículo cardíaco, causando mayor hipotensión de lo deseado.[12]
Puesto que los inhibidores de la ECA pueden ocasionar durante el embarazo, entre otros, hipotensión fetal, insuficiencia renal, trastornos del crecimiento y formación ósea en el bebé, además de estar relacionados con una tasa de mortalidad elevada, no deben administrarse durante este periodo y deben sustituirse por otras medidas terapéuticas indicadas.[10]
Interacciones medicamentosas
editarLos inhibidores de la enzima convertidora de angiotensina refuerzan los efectos secundarios que transforman el hemograma de los fármacos de efecto inmunosupresor (inmunosupresores, citostáticos y glucocorticoides). Igualmente, los inhibidores ECA potencian el efecto de reducción de azúcar en la sangre antidiabéticos orales e insulina.
En caso de intervenciones en el contenido de agua y electrolito se puede reducir la velocidad de eliminación del litio. Del mismo modo, puede observarse una potenciación del incremento del nivel de potasio o hiperpotasemia con el uso combinado con diuréticos ahorradores de potasio o con suplementos de potasio.
Los antiinflamatorios no esteroideos tienden a minimizar los efectos hipotensores de los IECA a través de la bradiquinina.
Combinado con otros fármacos que hacen descender la presión sanguínea debería controlarse si se produce una caída de la presión sanguínea. Los efectos sinérgicos que también pueden aprovecharse en tratamientos, aparecen especialmente con diuréticos y bloqueadores del canal de calcio. Se ha podido observar una reducción en el efecto de disminución de la presión sanguínea de los inhibidores ECA después de la ingestión de alimentos salados (sal).[cita requerida]
El tomar aspirina conjuntamente con un IECA puede mejorar la supervivencia de pacientes con insuficiencia cardíaca o una cardiopatía isquémica.[13]
Fármacos
editarActualmente, en muchos países están autorizados los siguientes inhibidores ECA como fármacos:
- Benazepril (Cibacen®)
- Enalapril (Xanef®, Pres®, muchos medicamentos genéricos)
- Captopril (Lopirin®, Tensobon®, (Capotén®en España) muchos medicamentos genéricos)
- Cilazapril (Dynorm®)
- Fosinopril (Fosinorm®, Dynacil®)
- Imidapril (Tanatril®)
- Lisinopril (Acerbon®, Coric®, medicamentos genéricos)
- Moexipril (Fempress®)
- Perindopril (Coversum®, Preterax®)
- Quinapril (Accupro®, medicamentos genéricos)
- Ramipril (Delix®, Vesdil®, medicamentos genéricos)
- Espirapril (Quadropril®)
- Trandolapril (Gopten®, Udrik®)
- Zofenopril (Presiam®, Zofenil®)
Algunos compuestos naturales como las casoquininas y lactoquininas, que son productos bioactivos de la descomposición de la caseína y del suero de leche, especialmente presentes en productos fermentados de la leche pueden tener un papel en el control de la tensión arterial,[14] similar a los IECA.[15] Los compuestos tri-peptídicos Val-Pro-Pro e Ile-Pro-Pro producidos por el Lactobacillus helveticus probiótico igualmente se han asociado a funciones antihipertensivas por inhibición de la ECA.[16]
Importancia económica
editarEn Alemania un 20 % de la población y una de cada dos personas mayores de 55 años toman fármacos para el tratamiento de la hipertensión. Aproximadamente el 35 % de los pacientes hipertensos recibe un tratamiento con un inhibidor ECA en tratamiento único y aproximadamente un 55 % en combinación con otro medicamento destinado a reducir la hipertensión.[cita requerida]
En Estados Unidos en 2001, se prescribieron 114 millones de cajas de inhibidores ECA. Esto equivale a una facturación total de unos 4,3 millones de dólares estadounidenses. La parte principal corre a cargo del inhibidor ECA lisinopril (47 %), seguido de enalapril (17 %), captopril y ramipril (cada uno 9 %). Sin embargo, en el mercado alemán, donde los medicamentos genéricos están muy extendidos, domina el fármaco enalapril.[cita requerida]
Alternativas
editarLas nuevas sustancias del grupo de los antagonistas del receptor de la angiotensina II ya no inhiben la enzima de conversión de la angiotensina, sino que tienen un efecto antagonista sobre el subtipo del receptor 1 de la angiotensina II, reduciendo posiblemente la aparición de efectos secundarios.[11] Sin embargo, los antagonistas AT1 siguen siendo mucho más caros que los inhibidores ECA, motivo por el cual no han llegado a sustituir a estos últimos. La mejor tolerancia se debe a que no afectan al sistema de la bradiquinina.
Los inhibidores de la vasopeptidasa como el omapatrilato derivan de los inhibidores ECA clásicos y están a punto de recibir la autorización de las autoridades sanitarias.[17] Además de la inhibición de la enzima de conversión de la angiotensina, los inhibidores de la vasopeptidasa bloquean la endopeptidasa neutra, una enzima responsable de inactivar las atriopeptinas (ANP), cuya función consiste en relajar los vasos sanguíneos.
Otro novedoso punto de intervención radica en el inhibidor de la enzima renina secretada por los riñones y que es responsable de sintetizar la angiotensina I. Con el A-72517 se está sometiendo a un ensayo clínico un inhibidor selectivo de dicha enzima.
Aspecto de medicina intensiva
editarEn la medicina intensiva se ha constado que los pacientes que han recibido un tratamiento con inhibidores ECA antes de su estancia en la unidad de cuidados intensivos presentan a menudo un mayor consumo de catecolaminas a fin de estabilizar la presión arterial. El motivo podría ser una carencia de la hormona antidiurética, que se podría atribuir a una terapia anterior con inhibidores ECA. Sustituyendo la hormona antidiurética, especialmente en pacientes que se encuentran en un dilema de catecolamina, puede reducirse rápidamente la necesidad de catecolamina (en tanto que no existan otros motivos responsables de una hipotensión) y en un periodo comprendido entre 12 y 24 horas puede compensarse la hormona antidiurética.[cita requerida]
En pacientes con insuficiencia cardíaca se nota que no toman los IECA prescritos al momento de un alta médica hospitalaria o los dejan de tomar antes del mes de salir del hospital. Un estudio demostró que cerca de un 33 % de estos pacientes dejan de tomar los IECA prescritos al cabo de un año, indicando la necesidad de hacer seguimiento en quienes se les prescriba medicamentos IECA.[18]
Referencias
editar- ↑ Leonard T. Skeggs, Jr., Joseph R. Kahn, y Norman P. Shumway. The preparation and function of the hypertensin-converting enzyme (artículo completo disponible en inglés). J Exp Med. 1956 February 29; 103(3): 295–299. Último acceso 16 de junio de 2008.
- ↑ Leonard T. Skeggs, Jr., Walton H. Marsh, Joseph R. Kahn, y Norman P. Shumway. The existence of two forms of hypertensin (artículo completo disponible en inglés). J Exp Med. 1954 February 28; 99(3): 275–282. Último acceso 16 de junio de 2008.
- ↑ Lewis I. Greene; Sergio H. Ferreira; y John Ad. Stewart.Bradykinin Potentiating Factor (en inglés). Chest, vol 59, No. 59, mayo de 1971. Último acceso 16 de junio de 2008.
- ↑ VandenBurg MJ, Sharman VL, Morton JJ, Williams GH, Marsh FP. Hormonal and blood pressure changes during converting enzyme inhibition by teprotide (en inglés). Postgrad Med J. 1981 May;57(667):283-8. Último acceso 16 de junio de 2008.
- ↑ Charles G. Smith y John R. Vane. The Discovery of Captopril (artículo completo disponible en inglés). The FASEB Journal. 2003;17:788-789. Último acceso 16 de junio de 2008.
- ↑ James Mason, et al. Safety and costs of initiating angiotensin converting enzyme inhibitors for heart failure in primary care: analysis of individual patient data from studies of left ventricular dysfunction (artículo completo disponible en inglés). BMJ 2000;321:1113-1116,1095-1096. Último acceso 17 de junio de 2008.
- ↑ LALLJIE, GR e LALLJIE, SE. Characteristics, treatment and short-term survival of patients with heart failure in a cardiology private practice in Jamaica. West Indian med. j. [online]. 2007, vol. 56, no. 2 [citado 2008-06-16], pp. 139-143. Disponible en: [1] Archivado el 17 de febrero de 2009 en Wayback Machine.. ISSN 0043-3144.
- ↑ Greenberg B, Quinones MA, Koilpillai C, Limacher M, Shindler D, Benedict C, Shelton. Effects of long-term enalapril therapy on cardiac structure and function in patients with left ventricular dysfunction. Results of the SOLVD echocardiography substudy (artículo completo disponible en inglés). Circulation 1995 May 15;91(10):2573-2581. Último acceso 17 de junio de 2008.
- ↑ GUTIÉRREZ GUTIÉRREZ, Carlos y SUÁREZ RODRÍGUEZ, Juan C. Nefropatía diabética: prevención o retraso por el médico general integral versus lamentos del nefrólogo. Rev Cubana Med Gen Integr [online]. 1997, vol. 13, no. 1 [citado 2008-06-17], pp. 19-27. Disponible en: [2]. ISSN 0864-2125.
- ↑ a b c JARA ALBARRAN, A. Nefropatía diabética. An. Med. Interna (Madrid). [online]. 2001, vol. 18, no. 4 [citado 2008-06-18], pp. 5-6. Disponible en: [3]. ISSN 0212-7199.
- ↑ a b c d e f g Katzung, Bertram G. (2007). «11». Basic & Clinical Pharmacology (9 edición). McGraw-Hill. pp. 250-253. ISBN 0071451536.
- ↑ a b c JORDAO, Míriam Gomes and SANTOS, Ari Tadeu Lírio dos. Arterial hypotension in myocardial revascularization surgery: influence of angiotensin-converting enzyme inhibitors. Rev. Bras. Anestesiol. [online]. 2002, vol. 52, no. 2 [citado 16 de junio de 2008], pp. 209-216. Disponible en la World Wide Web: [4]. ISSN 0034-7094. doi: 10.1590/S0034-70942002000200008
- ↑ Leor J, Reicher-Reiss H, Goldbourt U, et al. Aspirin and mortality in patients treated with angiotensin-converting enzyme inhibitors: a cohort study of 11,575 patients with coronary artery disease (artículo completo disponible en inglés). J Am Coll Cardiol. 1999;33:1920-1925. Último acceso 17 de junio de 2008.
- ↑ FitzGerald RJ, Murray BA, Walsh DJ. Hypotensive peptides from milk proteins. J Nutr 2004;134:980S-8S. PMID 15051858.
- ↑ María de Jesús Torres-Llanez, Belinda Vallejo-Cordoba y Aarón Fernando González-Córdova. Péptidos bioactivos derivados de las proteínas de la leche Archivado el 10 de junio de 2008 en Wayback Machine. (texto completo disponible en español). Archivos Latinoamericanos de Nutrición Año 2005, Volumen 55 - Número 2. Último acceso 16 de junio de 2008.
- ↑ Aihara K, Kajimoto O, Hirata H, Takahashi R, Nakamura Y. Effect of powdered fermented milk with Lactobacillus helveticus on subjects with high-normal blood pressure or mild hypertension. J Am Coll Nutr. 2005 Aug;24(4):257-65 PMID 16093403.
- ↑ Juan Tamargo y José López-Sendón. Bases y evidencias clínicas de los efectos de los nuevos tratamientos farmacológicos en la insuficiencia cardíaca (artículo completo disponible en español). Avances en el tratamiento de la insuficiencia cardíaca (IV). Mayo de 2004. Número 05- Volumen 57 p. 447 - 464. Último acceso 16 de junio de 2008.
- ↑ Javed Butler, Patrick Arbogast, James Daugherty, Manoj Jain, Wayne Ray, Marie Griffin. Outpatient utilization of angiotensin-converting enzyme inhibitors among heart failure patients after hospital discharge (en inglés). J Am Coll Cardiol. June 2, 2004, Volume 43, Issue 11 Pages 2036-2043. Último acceso 17 de junio de 2008.
Bibliografía
editar- D. W. Cusham, M. A. Ondetti: History of the design of captopril and related inhibitors of angiotensin converting enzyme. in: Hypertension. 17.1991, 589-592
- S. H. Ferreira, L. H. Greene, V. A. Alabaster, Y. S. Bakhle, J. R. Vane: History of the design of captopril and related inhibitors of angiotensin converting enzyme. in: Nature. Macmillan Journals, London 225.1970, 379-380. ISSN 0028-0836
Enlaces externos
editar- En MedlinePlus hay más información sobre Inhibidor de la enzima convertidora de angiotensina
- Inhibidores de la enzima convertidora de la angiotensina (ECA) Centro de Información Cardiovascular (Instituto del Corazón de Texas)
- Efectos fisiológicos y fisiopatológicos de la angiotensina II Diagrama de flujo en español. Programa de actualización continua para cardiología.