Tiocianato de mercurio
El tiocianato de mercurio (II) (Hg(SCN)2) es un compuesto químico inorgánico, el complejo coordinado de Hg2+ y el anión tiocianato. Es un polvo blanco. Cuando es encendido producirá una abultada y sinuosa “serpiente”, un efecto conocido como serpiente del faraón.[2]
| Tiocianato de mercurio | ||
|---|---|---|
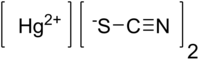 tiocianato de mercurio (II) | ||
| General | ||
| Otros nombres |
tiocianato de mercurio (II) sulfocianato de mercurio | |
| Fórmula estructural |
| |
| Fórmula molecular | Hg(SCN)2 | |
| Identificadores | ||
| Número CAS | 592-85-8[1] | |
| ChemSpider | 11126 | |
| PubChem | 11615 | |
| UNII | 3JNH1DM7IF | |
| Propiedades físicas | ||
| Apariencia |
polvo monoclínico blanco, inodoro | |
| Densidad | 3710 kg/m³; 3,71 g/cm³ | |
| Masa molar | 316,755 g/mol | |
| Punto de fusión | 438 K (165 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua |
0.069 g/100 mL | |
| Peligrosidad | ||
| SGA |
   | |
| NFPA 704 |
1
3
1
| |
| Frases H | H300, H310, H330, H373, H410 | |
| Frases P | P262, P273, P280, P301+P310+P330, P302+P352+P310[?], P304+P340+P310, P310 | |
| Riesgos | ||
| LD50 | 46 mg/kg (roedores, oral) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Síntesis
editarProbablemente, la primera síntesis de tiocianato de mercurio fue completada en 1821 por Jöns Jacob Berzelius:
- HgO + 2 HSCN → Hg(SCN)2 + H2O
Las pruebas de la primera muestra pura fueron presentadas en 1866, elaboradas por un químico llamado Otto Hermes.[2] Se elaboró mediante el tratamiento de soluciones que contenían mercurio (II) e iones tiocianato. El bajo producto de solubilidad del tiocianato de mercurio hace que se precipite en la solución.[3] La mayoría de las síntesis se consiguen mediante precipitación:
- Hg(NO3)2 + 2 KSCN → Hg(SCN)2 + 2KNO3
Serpiente del faraón
editarAntiguamente, el tiocianato de mercurio se utilizaba en pirotecnia provocando un efecto conocido como serpiente del faraón. Cuando el compuesto está en presencia de una fuente de calor lo suficientemente fuerte se inicia una rápida reacción exotérmica, lo que produce una gran masa embobinada como un serpiente sólida. Una llama poco visible que por lo general azul, aunque también puede ocurrir que sea amarilla o naranja, acompaña a la combustión. El sólido resultante puede variar de gris grafito oscuro a color canela encendido con la parte interior, generalmente, mucho más oscura que el exterior.[2]
Esta propiedad fue descubierta por Wöhler en 1821, poco tiempo después de la primera síntesis de tiocianato de mercurio: «Enrollado hacia fuera de sí mismo es similar al mismo tiempo que el proceso de los gusanos, muchas veces de su anterior masa, un material muy ligero de color grafito [...]» Por algún tiempo, un producto pirotécnico llamado „Pharaoschlangen“ estuvo a disposición del público alemán, pero finalmente fue prohibido cuando las propiedades tóxicas del producto fueron descubiertos luego del envenenamiento por mercurio que provocó la muerte de varios niños que comieron por error el sólido resultante.[2]
Aunque menos extremo, un efecto similar al de la serpiente del faraón se puede lograr utilizando un fuego artificial conocido como “serpiente negra”. Estos productos generalmente benignos, por lo general consiste en bicarbonato de sodio o una mezcla de aceite de linaza y naftalenos.[4]
Usos
editarEl tiocianato de mercurio tiene algunas aplicaciones en la síntesis química. Es el precursor del tritiocanato mercúrico de potasio (II) (K[Hg(SCN)3]) y el tritiocanato mercúrico de cesio (Cs[Hg(SCN)3]). El ion Hg(SCN)3- también puede existir de manera independiente, así podrá fácilmente reaccionar para formar los compuestos anteriores, entre otros.[5]
Sus reacciones con haluros orgánicos producen dos productos, uno con el azufre unido al compuesto orgánico y uno con el nitrógeno unido al compuesto orgánico.[6]
Uso en el análisis de cloruro
editarSe descubrió que el tiocianato de mercurio puede mejorar los límites de detección en la determinación de iones cloruro en el agua por espectroscopía ultravioleta-visible. Esta técnica fue sugerida por primera vez en 1952 y ha sido un método común para la determinación de iones cloruro en los laboratorios de todo el mundo desde entonces. Un sistema automatizado fue inventado en 1964 y luego un analizador de cloro comercial fue puesto a disposición en 1974 por Technicon (Tarrytown NY, los Estados Unidos). El mecanismo básico implica la adición de tiocianato de mercurio a una solución con concentración desconocida de iones cloruro y hierro como un reactivo. Los iones cloruro provocan que la sal de tiocianato de mercurio se disocie y el ion tiocianato se une al Fe (III), que absorbe intensamente a 450 nm. Esta absorción permite la medición de la concentración del complejo de hierro. Este valor permite calcular la concentración de cloruro.[7]
Se puede utilizar para determinar la concentración de iones cloruro en solución acuosa. El tiocianato de mercurio sin hierro (III) se añade a una solución con una concentración desconocida de iones cloruro, formando un complejo del tiocianato de mercurio y de iones cloruro que absorbe luz a unos 254 nm, lo que permite mediciones más precisas de la concentración que la técnica anteriormente mencionada utilizando hierro.[7]
Referencias
editar- ↑ Número CAS
- ↑ a b c d Davis, T. L. (1940). «Pyrotechnic snakes». Journal of Chemical Education 17 (6): 268-270. doi:10.1021/ed017p268.
- ↑ Sekine, T.; Ishii, T. (1970). «Studies of the liquid-liquid partition systems. VIII. The solvent extraction of mercury (II) chloride, bromide, iodide and thiocyanate with some organic solvents» (pdf). Bulletin of the Chemical Society of Japan 43 (8): 2422-2429. doi:10.1246/bcsj.43.2422. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ «Fun facts about baking soda and its uses». Australian Science. 11 de septiembre de 2014. Consultado el 12 de noviembre de 2014.
- ↑ Bowmaker, G. A.; Churakov, A. V.; Harris, R. K.; Howard, J. A. K.; Apperley, D. C. (1998). «Solid-state 199Hg MAS NMR studies of mercury(II) thiocyanate complexes and related compounds. Crystal structure of Hg(SeCN)2». Inorganic Chemistry 37 (8): 1734-1743. doi:10.1021/ic9700112.
- ↑ Kitamura, T.; Kobayashi, S.; Taniguchi, H. (1990). «Photolysis of vinyl halides. Reaction of photogenerated vinyl cations with cyanate and thiocyanate ions». Journal of Organic Chemistry 55 (6): 1801-1805. doi:10.1021/jo00293a025.
- ↑ a b Cirello-Egamino, J.; Brindle, I. D. (1995). «Determination of chloride ions by reaction with mercury thiocyanate in the absence of iron(III) using a UV-photometric, flow injection method». Analyst 120 (1): 183-186. doi:10.1039/AN9952000183.
Enlaces externos
editar- «Pharaoh's snake» (la decomposición del tiocianato de mercurio iniciada por calentamiento.) Vídeo didáctico en YouTube. 2 de septiembre de 2008. (en inglés)
- Esta obra contiene una traducción total derivada de «Mercury(II) thiocyanate» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
