Azida de hidrógeno
El ácido azothídrico, ácido hidrazoico, aziduro de hidrógeno, ácido nitrhídrico o nitruro de hidrógeno[3] es un ácido débil y tóxico, cuya fórmula es HN3, líquido a temperatura ambiente y muy volátil. Fue aislado por primera vez en 1890 por Theodor Curtius.[4]
| Azida de hidrógeno | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| Azida de hidrógeno | ||
| General | ||
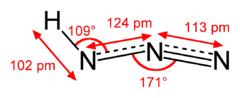
| Fórmula estructural |
 | |
| Fórmula molecular | HN3 | |
| Identificadores | ||
| Número CAS | 7782-79-8[1] | |
| ChEMBL | CHEMBL186537 | |
| Propiedades físicas | ||
| Apariencia | incoloro y volátil | |
| Densidad | 1090 kg/m³; 1,09 g/cm³ | |
| Masa molar | 4303 g/mol | |
| Punto de fusión | −80 °C (193 K) | |
| Punto de ebullición | 37 °C (310 K) | |
| Propiedades químicas | ||
| Acidez | 4,75[2] pKa | |
| Termoquímica | ||
| ΔfH0líquido | +264[2] kJ/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Síntesis
editarLa azida de hidrógeno se forma normalmente mediante la acidificación de una sal de azida, como la azida de sodio. Normalmente disoluciones de azida de sodio en agua contienen cantidades traza de ácido hidrazoico en equilibrio con la sal de azida, pero la introducción de un ácido más fuerte puede desplazar el equilibrio al ácido hidrazoico. El ácido puro puede ser posteriormente purificado por destilación fraccionada como un líquido incoloro muy explosivo con un olor desagradable. La reacción química consiste en:
- NaN3 + HCl → HN3 + NaCl
Aplicaciones
editarLa azida de hidrógeno tiene varias formas resonantes, que son las que las confieren sus propiedades químicas particulares:
Se usa para la síntesis de 1,2,3-Triazoles a partir de esta azida y un alquino por la reacción de cicloadición 1,3-dipolar.
El 2-furonitrilo, un agente edulcorante artificial y un potencial intermedio farmacéutico, ha sido preparado con un buen rendimiento mediante el tratamiento de furfural con una mezcla de ácido hidrazoico (HN3) y ácido perclórico en presencia de perclorato de magnesio en disolución de benceno a 35 °C.[5]
Propiedades físicas y reactividad
editarEl ácido azothídrico es soluble en agua, y esta solución es capaz de disolver muchos metales (zinc, hierro) con la liberación de hidrógeno y formación de azotiuros.
Todas sus sales son explosivas, o se descomponen a altas temperaturas, sus sales y ésteres se llaman nitruros. En sus propiedades se muestran similitudes con los ácidos de los elementos halógenos, de hecho, en solución acuosa, las formas de sus sales no son fácilmente solubles en contacto con el plomo, mercurio y plata. Estas sales metálicas se secan en forma anhidra y sometidos a una fuente de calor, se descomponen con fuerza dando nitrógeno y el metal en que consistía. Es un ácido débil, teniendo en constante disociación del ácido en torno a 4,6.
Toxicidad
editarEste ácido es extremadamente tóxico volátil y explosivo. Su olor insoportable y el violento dolor de cabeza causado por la inhalación de sus vapores hacen la intoxicación accidental efectivamente imposible. Este compuesto es un veneno de efecto acumulativo. La DL50 para un ratón, por vía aérea, es 34 mg/m³ mientras la LD50 por vía oral es 33 mg por cada kg de peso corporal. Los glóbulos rojos, tal vez a través de catálisis enzimática, pueden convertir los aziduros en óxido nítrico, un potente vasodilatador, con efectos también fatales.
Bibliografía
editar- ↑ Número CAS
- ↑ a b Catherine E. Housecroft; Alan G. Sharpe (2008). «Chapter 15: The group 15 elements». Inorganic Chemistry, 3rd Edition. Pearson. p. 449. ISBN 978-0-13-175553-6.
- ↑ Dictionary of Inorganic and Organometallic Compounds. Chapman & Hall.
- ↑ Curtius, Theodor (1890). Berichte 23: 3023.
- ↑ P. A. Pavlov; Kul'nevich, V. G. (1986). «Synthesis of 5-substituted furannitriles and their reaction with hydrazine». Khimiya Geterotsiklicheskikh Soedinenii 2: 181-186.
Véase también
editar- Portal:Química. Contenido relacionado con Química.
Enlaces externos
editar- Chemical Sampling Information: Hydrazoic Acid Archivado el 4 de abril de 2008 en Wayback Machine. (en inglés)