Fagocito
Los fagocitos (o células fagocíticas[1]) son células presentes en la sangre y otros tejidos animales capaces de captar microorganismos y restos celulares (en general, toda clase de partículas inútiles o nocivas para el organismo) e introducirlos en su interior con el fin de eliminarlos, en un proceso conocido como fagocitosis. Su nombre procede del griego phagein (φάγειν, 'comer'), y -cito, sufijo utilizado con el significado de 'célula', procedente del término kutos (κύτος, 'cavidad, urna').[2][3] Existen muchos tipos de células capaces de efectuar la fagocitosis; las células del sistema inmune que la realizan son de vital importancia en la defensa del organismo contra las infecciones.[4] Están presentes en todos los animales[5] y se encuentran muy desarrollados en los vertebrados.[6] Un litro de sangre humana contiene alrededor de seis mil millones de estas células.[7] Fueron descubiertos en 1882 en larvas de estrellas de mar por Iliá Ilich Méchnikov.[8] Debido a este trabajo, Méchnikov fue galardonado con el Premio Nobel en Fisiología o Medicina en 1908.[9] También se encuentran presentes en especies no animales; de hecho, algunas amebas poseen un comportamiento similar a los macrófagos (un tipo de fagocitos), lo que sugiere que aparecieron en una fase temprana de la evolución.[10]
| Fagocito | ||
|---|---|---|
|
| ||
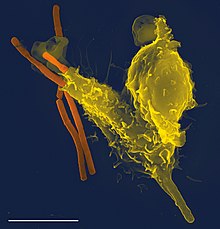
En sentido genérico, suele llamarse «fagocitos» a las células del sistema inmune con capacidad fagocítica (como los macrófagos). Siendo más precisos, no todos los fagocitos son glóbulos blancos o células inmunitarias: en humanos y otros animales se clasifican en «profesionales» y «no profesionales», dependiendo de su efectividad y de si poseen funciones distintas a la fagocitosis.[11] Los fagocitos profesionales incluyen a los neutrófilos, monocitos, macrófagos, células dendríticas; los fagocitos "no profesionales" incluyen elementos muy numerosos en el cuerpo humano y distintos a los leucocitos, como las células epiteliales, endoteliales, fibroblastos, microglía y células del mesénquima.[12] La diferencia fundamental entre los dos tipos es que los profesionales poseen receptores celulares en su superficie que son capaces de distinguir entre sustancias propias y ajenas al cuerpo.[13] Esta especificidad es la base del reconocimiento de lo propio frente a lo ajeno, y sustenta la defensa contra las infecciones mediada por el sistema inmune y el remodelado de los tejidos sanos (retirando las células muertas o no funcionales).[14]
Durante las infecciones, los fagocitos profesionales son atraídos a la zona invadida por patógenos mediante señales químicas procedentes de las bacterias o de otros fagocitos que se encuentran presentes previamente. La atracción, denominada quimiotaxis, se debe a que los receptores celulares presentes en la superficie del fagocito unen ciertas sustancias de los patógenos, lo que les permite reconocerlos y fagocitarlos.[15] Algunos fagocitos destruyen a los patógenos mediante especies reactivas del oxígeno y óxido nítrico.[16] Tras la fagocitosis, los macrófagos y las células dendríticas son capaces de participar en la presentación de antígeno (la manipulación de parte de las partículas que han fagocitado a fin de exponerlas en su superficie para que otras células del sistema inmune las reconozcan y se activen). Estas partes son «presentadas» a otras células inmunes; algunos de estos macrófagos y células dendríticas se desplazan a un nódulo linfático para efectuar la presentación a un elevado número de células. Este proceso es de vital importancia para generar inmunidad.[17] No obstante, algunos patógenos han desarrollado estrategias para evadir esta respuesta.[4]
Historia
editarEl zoólogo ruso Iliá Ilich Méchnikov (1845-1916) describió por primera vez que unas células especializadas estaban implicadas en la defensa contra infecciones microbianas. En 1882, estudiaba células motiles (de movimiento libre) en las larvas de estrellas de mar con la sospecha de que intervenían en la inmunidad celular. A fin de probar su hipótesis, insertó espinas de mandarino a las larvas. Tras unas horas, observó que las células motiles habían rodeado las púas.[18] Méchnikov viajó a Viena y compartió sus resultados con Carl Friedrich Claus, quien sugirió el nombre «fagocito» para estas células.[19]
Un año más tarde, Méchnikov estudió un crustáceo de agua dulce denominado Daphnia, un minúsculo animal transparente que se podía examinar directamente al microscopio. Descubrió que las esporas fúngicas que atacaban al animal eran destruidas por los fagocitos. Continuó sus observaciones con los leucocitos de los mamíferos y descubrió que la bacteria Bacillus anthracis podía ser absorbida y destruida por estas células en un proceso que bautizó como «fagocitosis».[20] Propuso así que los fagocitos servían para la defensa contra organismos invasores.
En 1903, Almroth Wright descubrió que la fagocitosis era reforzada por anticuerpos específicos que denominó opsoninas, del griego opson, condimento.[21] Méchnikov fue galardonado junto con Paul Ehrlich con el Premio Nobel de Fisiología o Medicina en 1908 por sus trabajos sobre los fagocitos y la fagocitosis.[9]
Aun cuando la importancia de estos descubrimientos fue aceptada a principios del siglo XX, las complicadas relaciones entre los fagocitos y el resto de componentes del sistema inmunitario no serían conocidas hasta la década de 1980.[22]
Fagocitosis
editarLa fagocitosis es el proceso de captura de partículas en el interior de una célula, ya sean bacterias, parásitos, células apoptóticas; en definitiva, toda clase de partícula extraña.[23] Involucra a varios procesos moleculares.[24] Se produce cuando estos elementos se unen a receptores de la superficie del fagocito, cambiando su estructura tridimensional e induciendo la inclusión de la partícula en el interior de la célula. En el caso de los neutrófilos humanos, la fagocitosis de bacterias se produce por término medio en nueve minutos.[25] Cada célula fagocítica posee un compartimento celular denominado fagosoma (en el que se almacena la partícula a eliminar) cuyo destino celular es la fusión con un lisosoma o gránulo para formar un fagolisosoma; en el caso de los neutrófilos humanos, la fusión sucede en un minuto. El orgánulo generado posee una batería de métodos enzimáticos que produce casi en todos los casos la muerte del elemento fagocitado en cuestión de minutos.[25] Las células dendríticas y los macrófagos no son tan efectivos como los neutrófilos y pueden prolongar el proceso hasta varias horas. Los macrófagos son lentos y, frecuentemente, expulsan el material a medio digerir al medio circundante; esta emisión atrae (recluta) a más fagocitos.[26] Los elementos fagocitados son muy diversos: algunas técnicas científicas consisten en la inducción de fagocitosis de incluso limaduras de hierro (de esta manera y empleando un imán es posible separar los fagocitos activos del resto de células y otros materiales).[27]
Cada fagocito posee varios tipos de receptores en su superficie que reconocen las partículas a fagocitar y que desencadenan el proceso de fagocitosis.[4] Entre ellos se encuentran las opsoninas, receptores tipo Scavenger y receptores de tipo Toll (TLRs). Las opsoninas activan la fagocitosis de bacterias recubiertas de Ig G o mediante proteínas del complemento (las cuales se activan mediante una cascada enzimática que favorecen la destrucción de elementos extraños en la sangre[28]). Los receptores tipo Scavenger reconocen una gran diversidad de moléculas de la superficie bacteriana. Los receptores de tipo Toll inducen la respuesta inflamatoria además de la fagocitosis; su nombre deriva de los receptores tipo Toll de Drosophila melanogaster, con quienes guardan cierta homología.[4]
Modos de acción
editarLa función de los fagocitos es destruir microbios o células dañadas;[29] el proceso puede realizarse intra o extracelularmente.
Mecanismo intracelular dependiente de oxígeno
editarCuando un fagocito actúa sobre un cuerpo extraño, como una bacteria, su consumo de oxígeno aumenta. El incremento en consumo de oxígeno recibe el nombre de estallido oxidativo, y produce especies reactivas del oxígeno con efectos antimicrobianos.[30] Los compuestos de oxígeno son tóxicos tanto para el patógeno como para la propia célula, por lo cual se retienen en compartimentos intracelulares. Este método de destruir microbios invasores mediante el uso de moléculas portadoras de especies reactivas de oxígeno recibe el nombre de destrucción intracelular dependiente de oxígeno. Este mecanismo se clasifica en dos tipos.[16]
- El primer tipo es la producción dependiente de oxígeno, en concreto del radical superóxido,[4] que es una sustancia bactericida rica en oxígeno.[31] El superóxido es transformado en presencia de peróxido de hidrógeno en oxígeno singlete, mediante una reacción catalizada por la enzima denominada superóxido dismutasa. Los radicales superóxido también reaccionan con radicales hidroxilo, que contribuyen a la destrucción del microbio invasor.[4]
- El segundo tipo implica el uso de la enzima mieloperoxidasa, presente en los gránulos de los neutrófilos.[32] Cuando los gránulos se fusionan con un fagosoma, se libera mieloperoxidasa al fagolisosoma, y esta enzima utiliza peróxido de hidrógeno y cloro para generar hipoclorito (la lejía doméstica es hipoclorito sódico diluido). El hipoclorito es extremadamente tóxico para las bacterias.[4] La mieloperoxidasa contiene un pigmento hemo, que hace que las secreciones ricas en neutrófilos, como el pus y los esputos infectados, sean de color verde.[33]
El proceso parece estar controlado por una proteína de la membrana mitocondrial, la UCP2, cuya misión es desacoplar la fosforilación oxidativa al consumo de oxígeno, bajando de esa forma el potencial de membrana y favoreciendo las rutas inversas de esta ruta metabólica, situación que se sabe que favorece la producción de radicales libres de oxígeno. Se ha visto que al menos, cuando los fagocitos consumen activamente células apoptóticas, esta proteína está sobrerregulada[34]
Mecanismo intracelular independiente de oxígeno
editarLos fagocitos también pueden matar microbios mediante cuatro métodos independientes de oxígeno, pero de forma más ineficiente. El primero utiliza proteínas con carga eléctrica que dañan la membrana bacteriana. El segundo utiliza lisozimas; estas enzimas destruyen la pared celular bacteriana. El tercero utiliza lactoferrinas presentes en los gránulos de los neutrófilos, que extraen el hierro del medio, metal que es esencial para las bacterias.[35] El cuarto tipo utiliza proteasas y enzimas hidrolíticas, que actúan digiriendo las proteínas de bacterias destruidas.[36]
Mecanismo extracelular
editarEl interferón gamma (antiguamente denominado factor activador de macrófagos) es un promotor de la producción de óxido nítrico por parte de los macrófagos. La fuente de la sustancia puede ser linfocitos T CD4+, linfocitos T CD8+, células NK, linfocitos B, linfocitos TNK, monocitos, macrófagos o células dendríticas.[37] El óxido nítrico es liberado por el macrófago y, debido a su toxicidad, mata a los microbios situados cerca del macrófago.[4] Los macrófagos activados producen y secretan factores de necrosis tumoral. Esta citoquina (un tipo de molécula señalizadora[38]) mata las células tumorales y a las infectadas por virus, y ayuda a activar al resto de células del sistema inmunitario.[39]
En algunas enfermedades, como por ejemplo la rara enfermedad granulomatosa crónica, la eficiencia de los fagocitos queda afectada y las infecciones bacterianas recurrentes se convierten en un problema.[40] En esta enfermedad, hay una anomalía que afecta diferentes elementos de la destrucción dependiente de oxígeno. Otros defectos congénitos raros, como por ejemplo el síndrome de Chédiak–Higashi, también están asociados con una destrucción defectuosa de los microbios fagocitados.[41]
Mecanismo contra virus
editarLos virus solo pueden reproducirse en el interior de las células, y acceden a ellas utilizando muchos de los receptores implicados en la inmunidad. Una vez en su interior, utilizan la maquinaria biológica de la célula para sus propios fines, obligándola a crear centenares de copias idénticas de ellos mismos. Aun cuando los fagocitos y otros componentes del sistema inmunitario innato pueden controlar los virus hasta un cierto punto, una vez que han penetrado dentro de una célula, la respuesta inmunitaria adaptativa, y más concretamente los linfocitos, son más importantes en la defensa.[42] En los lugares de infección vírica, los linfocitos a menudo son mucho más numerosos que el resto de células inmunitarias; así sucede en la meningitis vírica.[43] Los fagocitos eliminan a las células infectadas por virus.[44]
Rol en la apoptosis
editarEn los seres vivos, se produce una muerte continua de células, que se reemplazan por otras. El equilibrio entre la división celular y la muerte celular hace que el número de células permanezca relativamente constante en los adultos.[14] Las células pueden morir de dos maneras diferentes: por necrosis o por apoptosis. A diferencia de la necrosis, que a menudo es el resultado de enfermedad o trauma, la apoptosis (o muerte celular programada) es una función normal de las células. El cuerpo debe deshacerse de millones de células muertas o moribundas cada día, y los fagocitos tienen un papel crucial en este proceso, eliminando sus restos.[45]
Las células moribundas que se encuentran en la fase final de la apoptosis[46] presentan moléculas en su superficie que atraen a los fagocitos, como por ejemplo la fosfatidilserina.[47] La fosfatidilserina se encuentra normalmente en la superficie citosólica de la membrana plasmática, pero durante la apoptosis realiza un movimiento que la sitúa en la cara externa; este proceso está catalizado por una proteína hipotética denominada escramblasa.[48] Estos lípidos señalizan la célula como diana para las células dotadas de los receptores apropiados, como por ejemplo los macrófagos.[49] La eliminación de células moribundas mediante los fagocitos se produce de manera ordenada, sin provocar una respuesta inflamatoria, y es por tanto una de las funciones clave de estas células.[50]
Interacción con otras células
editarLos fagocitos no se encuentran en un órgano en concreto, sino que se mueven por el cuerpo, interaccionando con otras células (fagocitos o no) del sistema inmunitario. Pueden comunicarse con otras células produciendo sustancias químicas denominadas citoquinas, que atraen a otros fagocitos al lugar de infección o estimulan a los linfocitos no activados.[51] Los fagocitos forman parte del sistema inmunitario innato de todos los animales, incluyendo los humanos. La inmunidad innata es muy eficiente, pero no específica, puesto que no discrimina entre los diferentes tipos de invasores.[52] El sistema inmunitario adaptativo depende de los linfocitos, que no son fagocitos, pero que producen proteínas protectoras denominadas anticuerpos, que marcan a los invasores para ser destruidos y evitan que los virus infecten células.[53] Los fagocitos, y en concreto las células dendríticas y los macrófagos, estimulan la producción de los anticuerpos por parte de los linfocitos mediante un proceso denominado presentación de antígeno.[54]
Presentación de antígeno
editarLa presentación de antígeno es un proceso en el cual algunos fagocitos redirigen partes del material fagocitado a su superficie celular y lo «presentan» a otras células del sistema inmunitario.[55] Existen dos células presentadoras de antígeno «profesionales»: los macrófagos y las células dendríticas.[56] Tras su inclusión en el fagocito, las proteínas no propias (los antígenos) son degradados en péptidos en el interior de las células dendríticas y los macrófagos. Estos péptidos se unen a las glicoproteínas del complejo mayor de histocompatibilidad (MHC) de la célula, que los exponen en la superficie de los fagocitos, dónde pueden ser «presentados» a los linfocitos.[17] Los macrófagos maduros no se alejan demasiado del lugar de infección, pero las células dendríticas pueden llegar a los nódulos linfáticos, donde hay millones de linfocitos.[57] Esto mejora la inmunidad, puesto que los linfocitos responden allí a los antígenos presentados por las células dendríticas igual que lo harían en el lugar de la infección original.[58] Aun así, las células dendríticas no colaboran siempre con los linfocitos, y pueden destruirlos si es necesario, para proteger el cuerpo. Esto ocurre en un proceso denominado tolerancia.[59]
Tolerancia inmunitaria
editarLas células dendríticas también promueven la tolerancia inmunitaria,[60] que impide que el cuerpo se ataque a sí mismo. El primer tipo de tolerancia es la tolerancia central: cuando los linfocitos T abandonan el timo por primera vez, las células dendríticas destruyen los linfocitos T portadores de antígenos que podrían hacer que el sistema inmunitario se dañara a sí mismo (esto es, que confundiera lo «propio» con lo «ajeno»). El segundo tipo de tolerancia inmunitaria es la tolerancia periférica. Algunos linfocitos T portadores de antígenos que hacen que ataquen moléculas «propias» esquivan el primer proceso de tolerancia, algunos linfocitos T desarrollan antígenos que atacan a lo «propio» más adelante, y algunos antígenos que atacan a lo «propio» no se encuentran al timo; por esta razón, las células dendríticas limitan la actividad de los linfocitos T que atacan lo «propio» en el exterior del timo; esto se hace o bien destruyéndolos o bien buscando la ayuda de linfocitos T reguladores para desactivar las actividades de los linfocitos T perniciosos.[61] Cuando la tolerancia inmunitaria falla pueden aparecer enfermedades autoinmunes.[62] Por otro lado, una tolerancia excesiva permite que ciertas infecciones, como en algunos casos de infección por HIV, pasen desapercibidas.[61]
Fagocitos profesionales
editarLos fagocitos de los humanos y del resto de vertebrados mandibulados se dividen en grupos «profesionales» y «no profesionales» según la eficiencia de fagocitosis.[11] Los fagocitos profesionales son los monocitos, los macrófagos, los neutrófilos, las células dendríticas de los tejidos y los mastocitos.[12] Un litro de sangre humana contiene unos 6.000 millones de fagocitos.[7]
| Distribución de los fagocitos profesionales[63] | |
|---|---|
| Situación mayoritaria | Fenotipos |
| Sangre | neutrófilos, monocitos |
| Médula ósea | macrófagos, monocitos células sinusoidales |
| Tejido óseo | osteoclastos |
| Intestino y placas de Peyer | macrófagos |
| Tejido conectivo | histiocitos, macrófagos, monocitos, células dendríticas |
| Hígado | células de Kupffer, monocitos |
| Pulmón | macrófagos autorreplicativos, monocitos, mastocitos, células dendríticas |
| Sistema linfático | macrófagos y monocitos móviles y estáticos; células dendríticas |
| Sistema nervioso | microglía CD4+ |
| Bazo | macrófagos y monocitos móviles y estáticos; células sinusoidales |
| Timo | macrófagos y monocitos móviles y estáticos |
| Piel | células de Langerhans residentes, otras células dendríticas, macrófagos, mastocitos |
Fisiología
editarTodos los fagocitos, y especialmente los macrófagos, pueden presentar diferentes grados de actividad. Dependiendo de la presencia o no de patógenos y demás inductores de la respuesta inmunitaria, los fagocitos sufren procesos de activación y de migración al foco de actividad.
Activación
editarLos macrófagos suelen permanecer relativamente inactivos en los tejidos y proliferan lentamente. En este estado de reposo parcial, eliminan células propias muertas y otros residuos no infecciosos, y raramente participan en la presentación de antígenos. Aun así, durante una infección reciben señales químicas (habitualmente interferón gamma) que incrementan la producción de moléculas de MHC de clase II y que los preparan por presentar antígenos. En este estado, los macrófagos son buenos presentadores de antígeno y eliminadores de patógenos. Aun así, si reciben una señal directamente de un invasor, se «hiperactivan», dejan de proliferar y aumenta su capacidad destructiva. Esto incluye un aumento de la velocidad fagocítica; de hecho, algunos crecen lo suficiente como para absorber protozoos invasores.[64]
En la sangre, los neutrófilos son inactivos, pero fluyen a alta velocidad. Cuando reciben señales de macrófagos situados en un foco de infección, abandonan los vasos sanguíneos. Una vez dentro los tejidos, son activados por citoquinas y llegan al foco ya activados.[65]
Migración
editarCuando se produce una infección, el organismo envía una señal química de socorro para atraerlos al lugar de infección[66] Estas señales químicas pueden incluir proteínas de bacterias, péptidos de producidos durante la coagulación, productos del complemento y citoquinas liberadas por los macrófagos sito al tejido cerca del lugar de infección.[4] Otro grupo de atrayentes químico son las citoquinas, que reclutan neutrófilos y monocitos de la sangre.[67]
Para llegar al lugar de infección, los fagocitos abandonan la corriente sanguínea y penetran en los tejidos afectados. Las señales de la infección hacen que las células del endotelio (que tapiza la cara interna de los vasos sanguíneos) produzcan una proteína denominada selectina, a la cual se enganchan los neutrófilos para atravesar la pared. Otras señales denominadas vasodilatadores aflojan las uniones que conectan las células endoteliales, permitiendo que los fagocitos puedan pasar. La quimiotaxis es el proceso por el cual los fagocitos siguen el «rastro» de las citoquinas hasta el punto de infección.[4] Los neutrófilos atraviesan órganos cubiertos de células epiteliales hasta el punto de infección, y aun cuando es un componente importante del combate contra la infección, la migración en sí puede causar síntomas parecidos a los de la enfermedad.[68] Durante una infección, millones de neutrófilos son reclutados de la sangre, pero mueren tras unos días.[69]
Tipos
editarLos fagocitos profesionales incluyen a los neutrófilos, monocitos, macrófagos, células dendríticas y mastocitos.[12]
Monocitos
editarLos monocitos se desarrollan en la médula ósea y maduran en la sangre. Cuando están maduros tienen un núcleo grande, liso y lobulado y un citoplasma abundante que contiene gránulos. Ingieren sustancias no propias o peligrosas y presentan antígenos a otras células del sistema inmunitario. Los monocitos se dividen en dos grupos funcionales: un grupo circulando y un grupo marginal que permanece en otros tejidos (aproximadamente el 70 % se encuentra al grupo marginal). La mayoría de monocitos abandona el flujo sanguíneo tras 20-40 horas para dirigirse a los tejidos y los órganos, y en el proceso se transforman en macrófagos[70] o células dendríticas, según las señales que reciban.[71] Hay unos 500 millones de monocitos en un litro de sangre humana.[7]
Macrófagos
editarLos macrófagos maduros no viajan demasiado lejos, sino que vigilan las áreas del cuerpo que están expuestas al medio externo. Actúan como basureros, células presentadoras de antígeno o células asesinas, dependiendo de las señales que reciban.[72] Derivan de los monocitos, células madre granulocíticas, o simplemente de la división celular de macrófagos preexistentes.[73] Los macrófagos humanos tienen un diámetro de unos 21 micrómetros.[74]
Este tipo de fagocito no contiene gránulos sino que tiene muchos lisosomas. Los macrófagos se encuentran en cualquier parte del cuerpo, en casi todos los tejidos y órganos (como por ejemplo la microglía del cerebro y los macrófagos de los alvéolos pulmonares), donde permanecen a la espera. La localización de un macrófago puede determinar su medida y apariencia. Los macrófagos provocan inflamación mediante la producción de Interleucina-1, Interleucina-6 y TNF alfa.[75] Los macrófagos suelen encontrarse únicamente en los tejidos y raramente entran en el flujo sanguíneo. Se ha estimado la longevidad de los macrófagos tisulares oscila entre cuatro y quince días.[76]
Los macrófagos pueden activarse para ejecutar funciones que un monocito en reposo no podría llevar a término.[75] Los linfocitos T colaboradores (también conocidos como linfocitos T efectores o linfocitos Th), un subgrupo de linfocitos, son los responsables de la activación de los macrófagos. Los linfocitos Th1 activan los macrófagos mediante la señalización con interferón gamma y presentando la proteína CD154.[77] Otras señales incluyen el TNF alfa y lipopolisacáridos bacterianos.[75] Los linfocitos Th1 pueden atraer otros fagocitos al lugar de infección de varias maneras. Segregan citoquinas que actúan sobre la médula ósea para estimular la producción de monocitos y neutrófilos, y producen algunas de las citoquinas encargadas de la salida de éstos de la corriente sanguínea.[78] Los linfocitos Th1 derivan de la diferenciación de linfocitos T CD4+ después de que hayan respondido al antígeno a los tejidos linfáticos secundarios.[75] Los macrófagos activados tienen un papel importante en la destrucción de tumores mediante la producción de TNF alfa, IFN gamma, óxido nítrico, compuestos reactivos del oxígeno, proteínas catiónicas y enzimas hidrolíticos.[75]
Neutrófilos
editarLos neutrófilos suelen encontrarse en la sangre y son el tipo más abundante de fagocitos, representando un 50-60% del total de leucocitos en circulación.[79] Un litro de sangre humana contiene unos 5.000 millones de neutrófilos,[7] que tienen un diámetro de unos 10 micrómetros[80] y solo viven unos cinco días.[39] Una vez han recibido las señales apropiadas, tardan unos treinta minutos en abandonar la sangre y llegar al lugar de infección.[81] Son fagocitos muy efectivos y rápidamente absorben los invasores cubiertos de anticuerpos y elementos del complemento, así como células dañadas o residuos celulares. Los neutrófilos no vuelven a la sangre; mueren y pasan a formar parte del pus.[81] Los neutrófilos maduros son más pequeños que los monocitos, y tienen un núcleo multilobulado que, al microscopio, parece segmentado; no obstante, existe un solo núcleo, y cada parte está conectada mediante filamentos de cromatina; pueden tener entre dos y cinco segmentos. Los neutrófilos no suelen abandonar la médula ósea hasta que maduran, pero durante una infección en neonatos se liberan precursores de los neutrófilos denominados mielocitos y promielocitos.[82]
Las propiedades proteolíticas y bactericidas de los gránulos intracelulares de los neutrófilos humanos son bien conocidas.[83] Los neutrófilos pueden secretar productos que estimulan a los monocitos y macrófagos. Estas secreciones de los gránulos neutrófilos aumentan la fagocitosis y la formación de compuestos reactivos del oxígeno implicados en la destrucción intracelular.[84] Las secreciones de los gránulos azurófilos estimulan la fagocitosis de bacterias recubiertas con el anticuerpo IgG.[85]
Células dendríticas
editarLas células dendríticas son células presentadoras de antígeno especializadas dotadas de unas largas ramificaciones denominadas «dendritas»,[86] que les ayudan a absorber microbios y otros invasores.[87][88] Las células dendríticas se encuentran en los tejidos que están en contacto con el medio externo; principalmente la piel, la mucosa nasal, los pulmones, el estómago y los intestinos.[89] Una vez activadas, maduran y migran a los tejidos linfoides, dónde interactúan con linfocitos T y linfocitos B para iniciar y coordinar la respuesta inmunitaria adaptativa.[90]
Las células dendríticas maduras activan a los linfocitos T colaboradores y los linfocitos T citotóxicos.[91] Los linfocitos T colaboradores activados interactúan con los macrófagos y los linfocitos B para activarlos a su vez. Además, las células dendríticas pueden influir en el tipo de respuesta inmunitaria que se producirá; cuando se desplazan a las áreas linfoides donde se encuentran los linfocitos T, pueden activarlos, lo que redunda en su diferenciación en linfocitos T citotóxicos o linfocitos T colaboradores.[92]
Mastocitos
editarLos mastocitos o células cebadas tienen receptores de tipo Toll e interactúan con las células dendríticas, los linfocitos B y los linfocitos T para ayudar a intermediar las funciones inmunitarias adaptativas. Expresan moléculas de MHC de clase II[cita requerida]y pueden participar en la presentación de antígeno[cita requerida]; aun así, su papel no está demasiado bien comprendido, aunque se sugiere su implicación en procesos alérgicos.[93] Los mastocitos pueden fagocitar y destruir bacterias Gram negativas (como Salmonella) y procesar sus antígenos.[94] Se especializan en procesar las proteínas de las fimbrias de la superficie bacteriana, que están implicadas en la adhesión a tejidos.[95][96] Además de estas funciones, los mastocitos producen citoquinas que inducen la respuesta inflamatoria.[97] Se trata de una parte vital de la destrucción de microbios, puesto que reclutan a nuevos fagocitos.[94]
Fagocitos no profesionales
editarLas células dañadas y los elementos no propios también son fagocitados por células que no son fagocitos «profesionales».[98] Entre estas células destacan las células epiteliales, las endoteliales, los fibroblastos, la microglía y las células del mesénquima. Se las denomina, por tanto, «no profesionales», puesto que su papel fundamental no es la fagocitosis.[99] Los fibroblastos, por ejemplo, solo efectúan intentos ineficaces de fagocitosis de elementos no propios.[100]
Los fagocitos no profesionales están más limitados que los profesionales en cuanto al tipo de partículas que pueden tratar. Esto se debe a su carencia de receptores fagocíticos eficientes, especialmente opsoninas, que reconocen a anticuerpos y elementos del complemento unidos a patógenos.[13] Además, la mayoría de fagocitos no profesionales no producen moléculas reactivas de oxígeno en respuesta a la fagocitosis.[101]
| Localización | Fenotipos |
|---|---|
| Sangre, linfa y nódulos linfáticos | linfocitos |
| Sangre, linfa y nódulos linfáticos | células NK y linfocitos granulocitos grandes |
| Piel | células epiteliales |
| Vasos sanguíneos | células del endotelio |
| Tejido conectivo | fibroblastos |
| Sangre | eritrocitos |
Evasión y resistencia de patógenos
editarUn patógeno solo puede sobrevivir dentro del organismo al que infecta si soslaya la función del sistema inmune. Las bacterias y protozoos patógenos han desarrollado una serie de métodos de resistir el ataque de los fagocitos, y de hecho muchos pueden sobrevivir y replicarse al interior de células fagocíticas.[102][103]
Evitación del contacto
editarUna de las maneras que permiten al patógeno evadir la respuesta fagocítica consiste en crecer en lugares en donde no puedan llegar los fagocitos (como por ejemplo la superficie de la piel no rota). Otra estrategia es suprimir la respuesta inflamatoria; sin ella, los fagocitos no pueden responder de manera adecuada. Por otra parte, algunas especies de bacterias pueden interferir en la quimiotaxis de los fagocitos, impidiendo que se recluten en el foco de infección.[102] Finalmente, algunas bacterias pueden evitar el contacto con los fagocitos, engañando el sistema inmunitario para que no sea capaz de discernir que se trata de un elemento externo al organismo. Treponema pallidum (la bacteria causante de la sífilis) se esconde de los fagocitos cubriéndose de fibronectina,[104] que es producida de forma natural por el cuerpo y resulta esencial durante el proceso de cicatrización.[105]
Evitación de la absorción
editarLas bacterias a menudo producen proteínas o glúcidos que las recubren y que interfieren con la fagocitosis; es la denominada cápsula bacteriana,[102] como por ejemplo el antígeno K y el antígeno O 075 presentes a la superficie de Escherichia coli,[106] así como las cápsulas de exopolisacáridos de Staphylococcus epidermidis.[107] Los neumococos producen varios tipos de cápsula que les proporcionan diferentes grados de protección,[108] y los estreptococos del grupo A de Lansfield producen proteínas como por ejemplo la proteína M o proteínas de las fimbrias para impedir la absorción. Algunas proteínas obstaculizan la fagocitosis mediada por opsoninas; Staphylococcus aureus produce proteína A para bloquear receptores de anticuerpos, hecho que reduce la eficacia de las opsoninas.[109]
Supervivencia intracelular
editarAlgunas bacterias han desarrollado estrategias de supervivencia frente al proceso de fagocitosis, permaneciendo vivas en el interior de las células fagocíticas y por tanto evitando otros ataques procedentes del sistema inmunitario.[110] Para penetrar sin peligro al interior del fagocito, expresan proteínas denominadas «invasinas». Una vez dentro de la célula, permanecen en el citoplasma y evitan los productos tóxicos que contienen los fagolisosomas.[111] Algunas bacterias evitan que se fusionen un fagosoma y un lisosoma para formar el fagolisosoma.[102] Otros patógenos, como por ejemplo Leishmania, crean una vacuola altamente modificada dentro del fagocito que les ayuda a persistir y replicarse.[112] Legionella pneumophila produce secreciones que hacen que el fagosoma se fusione con vesículas que no son las que contienen sustancias tóxicas.[113] Otras bacterias son capaces de vivir dentro el fagolisosoma. Staphylococcus aureus, por ejemplo, produce las enzimas catalasa y superóxido dismutasa, que descomponen el peróxido de hidrógeno liberado por los fagocitos para matar a las bacterias.[114] Las bacterias pueden huir del fagosoma antes de que se forme el fagolisosoma: Listeria monocytogenes puede crear un agujero en la pared del fagosoma utilizando una enzima denominada listeriolisina O y fosfolipasa C.[115]
Destrucción del fagocito
editarLas bacterias han desarrollado varias maneras de matar fagocitos.[109] Son ejemplos las citolisinas, que forman poros en la membrana celular del fagocito; las estreptolisinas y leucocidinas, que hacen que los gránulos de los neutrófilos se rompan y liberen sustancias tóxicas,[116][117] y las exotoxinas, que reducen el suministro de ATP del fagocito, que lo consume durante la fagocitosis. Cuando una bacteria ha sido ingerida, puede destruir al fagocito mediante la liberación de toxinas que se mueven por el fagosoma o la membrana fagolisosómica para atacar otras partes de la célula.[102]
Alteración de la señalización celular
editarAlgunas estrategias de supervivencia a menudo implican la alteración de la ruta de las citoquinas u otras vías de señalización celular para evitar que los fagocitos respondan a la invasión.[118] Los protozoos parásitos de Toxoplasma gondii, Trypanosoma cruzi y Leishmania infectan macrófagos, y cada uno de ellos tiene su manera de vencerlos. Algunas especies de Leishmania alteran la señalización del macrófago infectado, impiden la producción de citoquinas y moléculas microbicidas (óxido nítrico y especies reactivas del oxígeno) y comprometen la presentación de antígeno.[119]
Daños al hospedador
editarLos macrófagos o los neutrófilos, en particular, tienen un papel esencial en el proceso inflamatorio, liberando proteínas y mediadores de bajo peso molecular que controlan las infecciones pero también pueden dañar tejidos del hospedador. En general, los fagocitos intentan destruir a los patógenos absorbiéndolos y sometiéndolos a una batería de sustancias tóxicas dentro del fagolisosoma. Si un fagocito no consigue absorber su objetivo, estos agentes tóxicos pueden ser liberados al medio (una acción conocida como «fagocitosis frustrada»). Como estos agentes también son tóxicos para las células huésped, pueden causar graves daños a células y tejidos sanos.[20]
Cuando los neutrófilos liberan el contenido de sus gránulos (compuestos reactivos del oxígeno y proteasas) en el riñón, el contenido degrada la matriz extracelular de sus células y puede causar daños a las células del glomérulo, afectando a la capacidad de filtrar la sangre. Además, los productos de las fosfolipasas (como los leucotrienos) agravan los daños. Esta liberación de sustancias promueve la quimiotaxis de más neutrófilos al lugar de infección y las células glomerulares pueden ser dañadas aún más por las moléculas de adhesión durante la migración de los neutrófilos. Los daños causados a las células glomerulares pueden provocar fallo renal.[120]
Los neutrófilos también tienen un papel clave en el desarrollo de la mayoría de formas de lesión pulmonar aguda.[121] En este caso, los neutrófilos activados liberan el contenido de sus gránulos tóxicos al interior del pulmón. No obstante, el tratamiento mediante una reducción del número de neutrófilos disminuye los efectos de la lesión pulmonar aguda, pero no es un método eficaz dado que aumenta su susceptibilidad a las infecciones.[122] Los daños de los neutrófilos pueden contribuir a disfunciones y lesiones hepáticas en respuesta a la liberación de endotoxinas producidas por bacterias, sepsis, trauma, hepatitis alcohólica, isquemia y choque hipovolémico causado por hemorragia aguda.[123]
Las sustancias liberadas por los macrófagos también pueden dañar tejidos del huésped. El TNF-α es una sustancia liberada por los macrófagos que hace que la sangre de los vasos sanguíneos pequeños coagule para evitar que se extienda una infección.[124] Aun así, si una infección bacteriana se extiende a través de la sangre, se libera TNF-α a los órganos vitales, hecho que puede provocar vasodilatación y una reducción del volumen de plasma; a su vez, esto puede conducir a un choque séptico. Durante un choque séptico, la liberación de TNF-α causa un bloqueo de los pequeños vasos que suministran sangre a los órganos vitales, y los órganos pueden fallar. El choque séptico puede conducir a la muerte.[15]
Origen evolutivo
editarLa fagocitosis es un proceso común en Biología y probablemente apareció en un momento temprano del evolución,[125] surgiendo por vez primera en eucariotas unicelulares.[126] Las amebas son protistas unicelulares que se separaron del árbol que conduce a los metazoos poco después de la divergencia con las plantas, pero comparten muchas funciones específicas con los fagocitos de mamíferos.[126] Dictyostelium discoideum, por ejemplo, es una ameba que vive en el suelo y se alimenta de bacterias. Como los fagocitos animales, absorbe bacterias mediante fagocitosis, principalmente mediante receptores de tipo Toll, y tiene otras funciones biológicas que también se dan en los macrófagos.[127] D. discoideum es social y, cuando le carece alimento, forma agregaciones multicelulares. Este organismo produce finalmente una fructificación con esporas que son resistentes a las amenazas ambientales. Antes de la formación de las estructuras, las células pueden migrar como organismos parecidos a una babosa durante unos días. Durante este tiempo, la exposición a toxinas o patógenos bacterianos puede comprometer la supervivencia de las amebas, limitando la producción de esporas. Algunas de las amebas absorben bacterias y toxinas mientras circulan dentro de la estructura multicelular, y finalmente mueren. Son genéticamente idénticas a las otras amebas, y su sacrificio para proteger las otras de las bacterias es parecido al sacrificio de células fagocíticas en el sistema inmune de vertebrados. Esta función inmunitaria innata en las amebas sociales sugiere que un mecanismo de alimentación celular muy antiguo podría haber sido adaptado con fines defensivos mucho antes de la diversificación de los animales.[128] Aun así, no se ha demostrado una descendencia común con la de los fagocitos de mamíferos. Los fagocitos existen en muchísimos animales,[5] desde las esponjas marinas hasta los vertebrados inferiores y superiores, pasando por los insectos.[129][130] La capacidad de las amebas de distinguir entre lo propio y lo ajeno es una capacidad esencial que se encuentra en la base del sistema inmunitario de muchas especies.[10]
Véase también
editarCitas
editar- ↑ «Curso de Introducción a la Inmunología Porcina. Segunda Edición - JM Sánchez-Vizcaíno». apps.sanidadanimal.info. Consultado el 22 de octubre de 2020.
- ↑ Little, C.; Fowler H.W.; Coulson J. (1983). The Shorter Oxford English Dictionary. Oxford University Press (Guild Publishing). pp. 1566-67.
- ↑ «κύτος». Diccionario Manual Griego: griego clásico - español. Vox: Spes. 1996.
κύτος εος [ους] τό cavidad, urna, escudo, coraza; piel, cuerpo; copa.
- ↑ a b c d e f g h i j Mayer, Gene (2006). «Immunology — Chapter One: Innate (non-specific) Immunity». Microbiology and Immunology On-Line Textbook. USC School of Medicine. Archivado desde el original el 7 de octubre de 2008. Consultado el 12 de noviembre de 2008.
- ↑ a b Delves et al., 2006, p. 250
- ↑ Delves et al., 2006, p. 251
- ↑ a b c d Hoffbrand, Pettit y Moss, 2005, p. 331
- ↑ Ilya Mechnikov, consultado el 13 de diciembre de 2009. DeNobel Lectures, Physiology or Medicine 1901–1921, Elsevier Publishing Company, Amsterdam, 1967.
- ↑ a b Schmalstieg, FC; AS Goldman (2008). «Ilya Ilich Metchnikoff (1845–1915) and Paul Ehrlich (1854–1915): the centennial of the 1908 Nobel Prize in Physiology or Medicine». Journal of medical biography 16 (2): 96-103. PMID 18463079. Archivado desde el original el 24 de julio de 2011.
- ↑ a b Janeway, Chapter: Evolution of the innate immune system. see Bibliography, consultado el 13 de diciembre de 2009
- ↑ a b Ernst y Stendahl, 2006, p. 186
- ↑ a b c Robinson y Babcock, 1998, p. 187 y Ernst y Stendahl, 2006, pp. 7–10
- ↑ a b Ernst y Stendahl, 2006, p. 10
- ↑ a b Thompson, CB (1995). «Apoptosis in the pathogenesis and treatment of disease». Science 267 (5203): 1456-62. PMID 7878464. doi:10.1126/science.7878464.
- ↑ a b Janeway, Chapter: Induced innate responses to infection.
- ↑ a b Fang FC (October de 2004). «Antimicrobial reactive oxygen and nitrogen species: concepts and controversies». Nat. Rev. Microbiol. 2 (10): 820-32. PMID 15378046. doi:10.1038/nrmicro1004.
- ↑ a b Janeway, Chapter: Antigen Presentation to T Lymphocytes. consultado el 13 de diciembre de 2009
- ↑ Delves et al., 2006, p. 3
- ↑ Aterman K (1 de abril de 1998). «Medals, memoirs—and Metchnikoff». J. Leukoc. Biol. 63 (4): 515-17. PMID 9544583. Archivado desde el original el 9 de diciembre de 2012. Consultado el 13 de diciembre de 2009.
- ↑ a b «Ilya Mechnikov». The Nobel Foundation. Consultado el 28 de noviembre de 2008.
- ↑ Delves et al., 2006, p. 263
- ↑ Robinson y Babcock, 1998, p. vii
- ↑ Ernst y Stendahl, 2006, p. 4
- ↑ Ernst y Stendahl, 2006, p. 78
- ↑ a b Hampton MB, Vissers MC, Winterbourn CC (February de 1994). «A single assay for measuring the rates of phagocytosis and bacterial killing by neutrophils». J. Leukoc. Biol. 55 (2): 147-52. PMID 8301210. Archivado desde el original el 28 de diciembre de 2012. Consultado el 29 de abril de 2010.
- ↑ Sompayrac, 2008, p. 3
- ↑ Sompayrac, 2008, p. 2
- ↑ Sompayrac, 2008, pp. 13–16
- ↑ Dale DC, Boxer L, Liles WC (August de 2008). «The phagocytes: neutrophils and monocytes». Blood 112 (4): 935-45. PMID 18684880. doi:10.1182/blood-2007-12-077917.
- ↑ Dahlgren, C; A Karlsson (17 de diciembre de 1999). «Respiratory burst in human neutrophils.». Journal of Immunological Methods 232 (1–2): 3-14. PMID 10618505. doi:10.1016/S0022-1759(99)00146-5.
- ↑ Shatwell, KP; AW Segal (1996). «NADPH oxidase.». The international journal of biochemistry and cell biology. 28 (11): 1191-95. PMID 9022278. doi:10.1016/S1357-2725(96)00084-2.
- ↑ Klebanoff SJ (1999). «Myeloperoxidase». Proc. Assoc. Am. Physicians 111 (5): 383-89. PMID 10519157.
- ↑ Meyer KC (September de 2004). «Neutrophils, myeloperoxidase, and bronchiectasis in cystic fibrosis: green is not good». J. Lab. Clin. Med. 144 (3): 124-26. PMID 15478278. doi:10.1016/j.lab.2004.05.014.
- ↑ Park, Daeho; Claudia Z. Han, Michael R. Elliott, Jason M. Kinchen, Paul C. Trampont, Soumita Das, Sheila Collins, Jeffrey J. Lysiak, Kyle L. Hoehn, Kodi S. Ravichandran (21 de agosto de 2011). «Continued clearance of apoptotic cells critically depends on the phagocyte Ucp2 protein». Nature 477: 220-224. ISSN 0028-0836. doi:10.1038/nature10340. Consultado el 10 de septiembre de 2011.
- ↑ Hoffbrand, Pettit y Moss, 2005, p. 118
- ↑ Delves et al., 2006, pp. 6–10
- ↑ Schroder K, Hertzog PJ, Ravasi T, Hume DA (February de 2004). «Interferon-gamma: an overview of signals, mechanisms and functions». J. Leukoc. Biol. 75 (2): 163-89. PMID 14525967. doi:10.1189/jlb.0603252. Archivado desde el original el 3 de julio de 2010.
- ↑ Delves et al., 2006, p. 188
- ↑ a b Sompayrac, 2008, p. 17
- ↑ Lipu HN, Ahmed TA, Ali S, Ahmed D, Waqar MA (Septiembre de 2008). «Chronic granulomatous disease». J Pak Med Assoc 58 (9): 516-18. PMID 18846805.
- ↑ Kaplan J, De Domenico I, Ward DM (January de 2008). «Chediak-Higashi syndrome». Curr. Opin. Hematol. 15 (1): 22-29. PMID 18043242. doi:10.1097/MOH.0b013e3282f2bcce. Archivado desde el original el 11 de mayo de 2012. Consultado el 13 de diciembre de 2009.
- ↑ Sompayrac, 2008, p. 7
- ↑ de Almeida SM, Nogueira MB, Raboni SM, Vidal LR (October de 2007). «Laboratorial diagnosis of lymphocytic meningitis». Braz J Infect Dis 11 (5): 489-95. PMID 17962876. Consultado el 29 de marzo de 2009.
- ↑ Sompayrac, 2008, p. 22
- ↑ Delves pp. 171–184
- ↑ «Apoptosis». Merriam-Webster Online Dictionary. Consultado el 19 de marzo de 2009.
- ↑ Li MO, Sarkisian MR, Mehal WZ, Rakic P, Flavell RA (November de 2003). «Phosphatidylserine receptor is required for clearance of apoptotic cells». Science (journal) 302 (5650): 1560-63. PMID 14645847. doi:10.1126/science.1087621.
- ↑ Wang X, et al. (2003). «Cell corpse engulfment mediated by C. elegans phosphatidylserine receptor through CED-5 and CED-12». Science 302 (5650): 1563-1566. PMID 14645848. doi:10.1126/science.1087641.
- ↑ Savill J, Gregory C, Haslett C. (2003). «Eat me or die». Science 302 (5650): 1516-17. PMID 14645835. doi:10.1126/science.1092533.
- ↑ Zhou Z, Yu X (October de 2008). «Phagosome maturation during the removal of apoptotic cells: receptors lead the way». Trends Cell Biol. 18 (10): 474-85. PMID 18774293. doi:10.1016/j.tcb.2008.08.002.
- ↑ Sompayrac, 2008, p. 44
- ↑ Sompayrac, 2008, pp. 4 y ss
- ↑ Sompayrac, 2008, pp. 24–35
- ↑ Delves et al., 2006, pp. 171–184
- ↑ Delves et al., 2006, pp. 456
- ↑ Timothy Lee (2004). «Antigen Presenting Cells (APC)». Immunology for 1st Year Medical Students. Dalhousie University. Archivado desde el original el 12 de enero de 2008. Consultado el 19 de diciembre de 2009.
- ↑ Delves et al., 2006, p. 161
- ↑ Sompayrac, 2008, p. 8
- ↑ Delves et al., 2006, pp. 237–242
- ↑ Lange C, Dürr M, Doster H, Melms A, Bischof F (2007). «Dendritic cell-regulatory T-cell interactions control self-directed immunity». Immunol. Cell Biol. 85 (8): 575-81. PMID 17592494. doi:10.1038/sj.icb.7100088.
- ↑ a b Steinman, Ralph M. (2004). «Dendritic Cells and Immune Tolerance». The Rockefeller University. Archivado desde el original el 11 de marzo de 2009. Consultado el 15 de febrero de 2009.
- ↑ Romagnani, S (2006). «Immunological tolerance and autoimmunity.». Internal and emergency medicine. 1 (3): 187-96. PMID 17120464. doi:10.1007/BF02934736.
- ↑ a b Paoletti, Notario y Ricevuti, 1997, p. 427
- ↑ Sompayrac, 2008, pp. 16–17
- ↑ Sompayrac, 2008, pp. 18–19
- ↑ Delves et al., 2006, p. 6
- ↑ Janeway, Capítulo: Induced innate responses to infection. Véase a bibliografía
- ↑ Zen K, Parkos CA (October de 2003). «Leukocyte-epithelial interactions». Curr. Opin. Cell Biol. 15 (5): 557-64. PMID 14519390. doi:10.1016/S0955-0674(03)00103-0. Consultado el 19 de diciembre de 2009.
- ↑ Sompayrac, 2008, p. 79
- ↑ Hoffbrand, Pettit y Moss, 2005, p. 117
- ↑ Delves et al., 2006, pp. 1–6
- ↑ Sompayrac, 2008, p. 45
- ↑ Takahashi K, Naito M, Takeya M (July de 1996). «Development and heterogeneity of macrophages and their related cells through their differentiation pathways». Pathol. Int. 46 (7): 473-85. PMID 8870002. doi:10.1111/j.1440-1827.1996.tb03641.x.
- ↑ Krombach F, Münzing S, Allmeling AM, Gerlach JT, Behr J, Dörger M (September de 1997). «Cell size of alveolar macrophages: an interspecies comparison». Environ. Health Perspect. 105 Suppl 5: 1261-63. PMC 1470168. PMID 9400735. doi:10.2307/3433544.
- ↑ a b c d e Bowers, William (2006). «Immunology -Chapter Thirteen: Immunoregulation». Microbiology and Immunology On-Line Textbook. USC School of Medicine. Archivado desde el original el 23 de diciembre de 2008. Consultado el 14 de noviembre de 2008.
- ↑ Ernst y Stendahl, 2006, p. 8
- ↑ Delves et al., 2006, p. 156
- ↑ Delves et al., 2006, p. 187
- ↑ Stvrtinová, Viera; Ján Jakubovský and Ivan Hulín (1995). «Neutrophils, central cells in acute inflammation». Inflammation and Fever from Pathophysiology: Principles of Disease. Computing Centre, Slovak Academy of Sciences: Academic Electronic Press. ISBN 80-967366-1-2. Archivado desde el original el 31 de diciembre de 2010. Consultado el 28 de marzo de 2009.
- ↑ Delves et al., 2006, p. 4
- ↑ a b Sompayrac, 2008, p. 18
- ↑ Linderkamp O, Ruef P, Brenner B, Gulbins E, Lang F (December de 1998). «Passive deformability of mature, immature, and active neutrophils in healthy and septicemic neonates». Pediatr. Res. 44 (6): 946-50. PMID 9853933. doi:10.1203/00006450-199812000-00021. Consultado el 6 de abril de 2009.
- ↑ Paoletti, Notario y Ricevuti, 1997, p. 62
- ↑ Soehnlein O, Kenne E, Rotzius P, Eriksson EE, Lindbom L (Enero de 2008). «Neutrophil secretion products regulate anti-bacterial activity in monocytes and macrophages». Clin. Exp. Immunol. 151 (1): 139-45. PMC 2276935. PMID 17991288. doi:10.1111/j.1365-2249.2007.03532.x. Consultado el 19 de diciembre de 2009. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ Soehnlein O, Kai-Larsen Y, Frithiof R, et al (Octubre de 2008). «Neutrophil primary granule proteins HBP and HNP1-3 boost bacterial phagocytosis by human and murine macrophages». J. Clin. Invest. 118 (10): 3491-502. PMC 2532980. PMID 18787642. doi:10.1172/JCI35740. Consultado el 29 de marzo de 2009.
- ↑ Steinman RM, Cohn ZA (1973). «Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution». J. Exp. Med. 137 (5): 1142-62. PMC 2139237. PMID 4573839. doi:10.1084/jem.137.5.1142.
- ↑ Steinman, Ralph. «Dendritic Cells». The Rockefeller University. Archivado desde el original el 27 de junio de 2009. Consultado el 14 de noviembre de 2008.
- ↑ Guermonprez P, Valladeau J, Zitvogel L, Théry C, Amigorena S (2002). «Antigen presentation and T cell stimulation by dendritic cells». Annu. Rev. Immunol. 20: 621-67. PMID 11861614. doi:10.1146/annurev.immunol.20.100301.064828. Consultado el 29 de marzo de 2009.
- ↑ Hoffbrand, Pettit y Moss, 2005, p. 134
- ↑ Sallusto F, Lanzavecchia A (2002). «The instructive role of dendritic cells on T-cell responses». Arthritis Res. 4 Suppl 3: S127-32. PMID 12110131. doi:10.1186/ar567.
- ↑ Sompayrac, 2008, pp. 42–46
- ↑ Steinman, Ralph. «Dendritic Cells». The Rockefeller University. Archivado desde el original el 27 de junio de 2009. Consultado el 16 de noviembre de 2008.
- ↑ Stelekati E, Orinska Z, Bulfone-Paus S (2007). «Mast cells in allergy: innate instructors of adaptive responses». Immunobiology 212 (6): 505-19. PMID 17544835. doi:10.1016/j.imbio.2007.03.012. Consultado el 29 de marzo de 2009.
- ↑ a b Malaviya R, Abraham SN (Enero de 2001). «Mast cell modulation of immune responses to bacteria». Immunol. Rev. 179: 16-24. PMID 11292019. doi:10.1034/j.1600-065X.2001.790102.x. Consultado el 19 de diciembre de 2009. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ Connell I, Agace W, Klemm P, Schembri M, Mărild S, Svanborg C (Septiembre de 1996). «Type 1 fimbrial expression enhances Escherichia coli virulence for the urinary tract». Proc. Natl. Acad. Sci. U.S.A. 93 (18): 9827-32. PMC 38514. PMID 8790416. doi:10.1073/pnas.93.18.9827.
- ↑ Malaviya R, Twesten NJ, Ross EA, Abraham SN, Pfeifer JD (Febrero de 1996). «Mast cells process bacterial Ags through a phagocytic route for class I MHC presentation to T cells». J. Immunol. 156 (4): 1490-96. PMID 8568252. Consultado el 19 de diciembre de 2009.
- ↑ Taylor ML, Metcalfe DD (2001). «Mast cells in allergy and host defense». Allergy Asthma Proc 22 (3): 115-19. PMID 11424870. doi:10.2500/108854101778148764. Consultado el 29 de marzo de 2009.
- ↑ Birge RB, Ucker DS (Julio de 2008). «Innate apoptotic immunity: the calming touch of death». Cell Death Differ. 15 (7): 1096-1102. PMID 18451871. doi:10.1038/cdd.2008.58.
- ↑ Couzinet S, Cejas E, Schittny J, Deplazes P, Weber R, Zimmerli S (December de 2000). «Phagocytic uptake of Encephalitozoon cuniculi by nonprofessional phagocytes». Infect. Immun. 68 (12): 6939-45. PMC 97802. PMID 11083817. doi:10.1128/IAI.68.12.6939-6945.2000. Archivado desde el original el 8 de junio de 2020. Consultado el 20 de diciembre de 2009.
- ↑ Segal G, Lee W, Arora PD, McKee M, Downey G, McCulloch CA. Involvement ofactin filaments and integrins in the binding step in collagen phagocytosis byhuman fibroblasts. J Cell Sci. 2001 Jan;114(Pt 1):119–129. PubMed PMID 11112696
- ↑ Rabinovitch M (March de 1995). «Professional and non-professional phagocytes: an introduction». Trends Cell Biol. 5 (3): 85-87. PMID 14732160. doi:10.1016/S0962-8924(00)88955-2.
- ↑ a b c d e Todar, Kenneth. «Mechanisms of Bacterial Pathogenicity: Bacterial Defense Against Phagocytes». 2008. Consultado el 10 de diciembre de 2008.
- ↑ Alexander J, Satoskar AR, Russell DG (Septiembre de 1999). «Leishmania species: models of intracellular parasitism». J. Cell. Sci. 112 Pt 18: 2993-3002. PMID 10462516.
- ↑ Celli J, Finlay BB (Mayo de 2002). «Bacterial avoidance of phagocytosis». Trends Microbiol. 10 (5): 232-37. PMID 11973157. doi:10.1016/S0966-842X(02)02343-0.
- ↑ Valenick LV, Hsia HC, Schwarzbauer JE (Septiembre de 2005). «Fibronectin fragmentation promotes alpha4beta1 integrin-mediated contraction of a fibrin-fibronectin provisional matrix». Experimental cell research 309 (1): 48-55. PMID 15992798. doi:10.1016/j.yexcr.2005.05.024.
- ↑ Burns SM, Hull SI (Agosto de 1999). «Loss of resistance to ingestion and phagocytic killing by O(-) and K(-) mutants of a uropathogenic Escherichia coli O75:K5 strain». Infect. Immun. 67 (8): 3757-62. PMC 96650. PMID 10417134. Consultado el 29 de marzo de 2009.
- ↑ Vuong C, Kocianova S, Voyich JM, et al (Diciembre de 2004). «A crucial role for exopolysaccharide modification in bacterial biofilm formation, immune evasion, and virulence». J. Biol. Chem. 279 (52): 54881-86. PMID 15501828. doi:10.1074/jbc.M411374200. Consultado el 29 de marzo de 2009.
- ↑ Melin M, Jarva H, Siira L, Meri S, Käyhty H, Väkeväinen M (February de 2009). «Streptococcus pneumoniae capsular serotype 19F is more resistant to C3 deposition and less sensitive to opsonophagocytosis than serotype 6B». Infect. Immun. 77 (2): 676-84. PMID 19047408. doi:10.1128/IAI.01186-08. Consultado el 29 de marzo de 2009.
- ↑ a b Foster TJ (Diciembre de 2005). «Immune evasion by staphylococci». Nat. Rev. Microbiol. 3 (12): 948-58. PMID 16322743. doi:10.1038/nrmicro1289.
- ↑ Sansonetti P (Diciembre de 2001). «Phagocytosis of bacterial pathogens: implications in the host response». Semin. Immunol. 13 (6): 381-90. PMID 11708894. doi:10.1006/smim.2001.0335.
- ↑ Dersch P, Isberg RR (Marzo de 1999). «A region of the Yersinia pseudotuberculosis invasin protein enhances integrin-mediated uptake into mammalian cells and promotes self-association». EMBO J. 18 (5): 1199-1213. PMC 1171211. PMID 10064587. doi:10.1093/emboj/18.5.1199.
- ↑ Antoine JC, Prina E, Lang T, Courret N (Octubre de 1998). «The biogenesis and properties of the parasitophorous vacuoles that harbour Leishmania in murine macrophages». Trends Microbiol. 6 (10): 392-401. PMID 9807783. doi:10.1016/S0966-842X(98)01324-9.
- ↑ Masek, Katherine S.; Christopher A. Hunter (2007). Eurekah Bioscience Collection: Evasion of Phagosome Lysosome Fusion and Establishment of a Replicative Organelle by the Intracellular Pathogen Legionella pneumophila. Landes Bioscience. Consultado el 20 de marzo de 2009.
- ↑ Das D, Saha SS, Bishayi B (Julio de 2008). «Intracellular survival of Staphylococcus aureus: correlating production of catalase and superoxide dismutase with levels of inflammatory cytokines». Inflamm. Res. 57 (7): 340-49. PMID 18607538. doi:10.1007/s00011-007-7206-z.
- ↑ Hara H, Kawamura I, Nomura T, Tominaga T, Tsuchiya K, Mitsuyama M (Agosto de 2007). «Cytolysin-dependent escape of the bacterium from the phagosome is required but not sufficient for induction of the Th1 immune response against Listeria monocytogenes infection: distinct role of Listeriolysin O determined by cytolysin gene replacement». Infect. Immun. 75 (8): 3791-3801. PMC 1951982. PMID 17517863. doi:10.1128/IAI.01779-06.
- ↑ Datta V, Myskowski SM, Kwinn LA, Chiem DN, Varki N, Kansal RG, Kotb M, Nizet V (Mayo de 2005). «Mutational analysis of the group A streptococcal operon encoding streptolysin S and its virulence role in invasive infection». Mol. Microbiol. 56 (3): 681-95. PMID 15819624. doi:10.1111/j.1365-2958.2005.04583.x.
- ↑ Iwatsuki K, Yamasaki O, Morizane S, Oono T (June de 2006). «Staphylococcal cutaneous infections: invasion, evasion and aggression». J. Dermatol. Sci. 42 (3): 203-14. PMID 16679003. doi:10.1016/j.jdermsci.2006.03.011.
- ↑ Denkers EY, Butcher BA (Enero de 2005). «Sabotage and exploitation in macrophages parasitized by intracellular protozoans». Trends Parasitol. 21 (1): 35-41. PMID 15639739. doi:10.1016/j.pt.2004.10.004. Consultado el 20 de diciembre de 2009.
- ↑ Gregory DJ, Olivier M (2005). «Subversion of host cell signalling by the protozoan parasite Leishmania». Parasitology. 130 Suppl: S27-35. PMID 16281989. doi:10.1017/S0031182005008139. Consultado el 20 de diciembre de 2009.
- ↑ Heinzelmann M, Mercer-Jones MA, Passmore JC (Agosto de 1999). «Neutrophils and renal failure». Am. J. Kidney Dis. 34 (2): 384-99. PMID 10430993. doi:10.1016/S0272-6386(99)70375-6.
- ↑ Lee WL, Downey GP (Febrero de 2001). «Neutrophil activation and acute lung injury». Curr Opin Crit Care 7 (1): 1-7. PMID 11373504. doi:10.1097/00075198-200102000-00001.
- ↑ Moraes TJ, Zurawska JH, Downey GP (Enero de 2006). «Neutrophil granule contents in the pathogenesis of lung injury». Curr. Opin. Hematol. 13 (1): 21-27. PMID 16319683. doi:10.1097/01.moh.0000190113.31027.d5.
- ↑ Ricevuti G (Diciembre de 1997). «Host tissue damage by phagocytes». Ann. N. Y. Acad. Sci. 832: 426-48. PMID 9704069. doi:10.1111/j.1749-6632.1997.tb46269.x. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ Charley B, Riffault S, Van Reeth K (Octubre de 2006). «Porcine innate and adaptative immune responses to influenza and coronavirus infections». Ann. N. Y. Acad. Sci. 1081: 130-36. PMID 17135502. doi:10.1196/annals.1373.014. Consultado el 31 de marzo de 2009. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ Sompayrac, 2008, p. 1
- ↑ a b Cosson P, Soldati T (June de 2008). «Eat, kill or die: when amoeba meets bacteria». Curr. Opin. Microbiol. 11 (3): 271-76. PMID 18550419. doi:10.1016/j.mib.2008.05.005. Consultado el 20 de diciembre de 2009.
- ↑ Bozzaro S, Bucci C, Steinert M (2008). «Phagocytosis and host-pathogen interactions in Dictyostelium with a look at macrophages». Int Rev Cell Mol Biol 271: 253-300. PMID 19081545. doi:10.1016/S1937-6448(08)01206-9. Consultado el 20 de diciembre de 2009.
- ↑ Chen G, Zhuchenko O, Kuspa A (Agosto de 2007). «Immune-like phagocyte activity in the social amoeba». Science (journal) 317 (5838): 678-81. PMID 17673666. doi:10.1126/science.1143991.
- ↑ Delves et al., 2006, pp. 251–252
- ↑ Hanington PC, Tam J, Katzenback BA, Hitchen SJ, Barreda DR, Belosevic M (Abril de 2009). «Development of macrophages of cyprinid fish». Dev. Comp. Immunol. 33 (4): 411-29. PMID 19063916. doi:10.1016/j.dci.2008.11.004. Consultado el 5 de abril de 2009.
Bibliografía
editarBibliografía en inglés
editar- Delves, P. J.; Martin, S. J.; Burton, D. R.; Roit, I. M. (2006), Roitt's Essential Immunology (11th edición), Malden, MA: Blackwell Publishing, ISBN 1405136030.
- Ernst, J. D.; Stendahl, O., eds. (2006), Phagocytosis of Bacteria and Bacterial Pathogenicity, New York: Cambridge University Press, ISBN 0521845696.
- Hoffbrand, A. V.; Pettit, J. E.; Moss, P. A. H. (2005), Essential Haematology (4th edición), London: Blackwell Science, ISBN 0632051531.
- Janeway, C. A.; Murphy, K. M.; Travers, P.; Walport, M. (2001), Immunobiology (5th edición), New York: Garland Science, ISBN 081533642X.
- Paoletti, R.; Notario, A.; Ricevuti, G., eds. (1997), Phagocytes: Biology, Physiology, Pathology, and Pharmacotherapeutics, New York: The New York Academy of Sciences, ISBN 1573311022.
- Robinson, J. P.; Babcock, G. F., eds. (1998), Phagocyte Function — A guide for research and clinical evaluation, New York: Wiley–Liss, ISBN 0471123641.
- Sompayrac, L. (2008), How the Immune System Works (3rd edición), Malden, MA: Blackwell Publishing, ISBN 9781405162210.
Enlaces externos
editar- Wikimedia Commons alberga una categoría multimedia sobre Fagocito.
- Phagocytes in National Library of Medicine - Medical Subject Headings (en inglés)